Type 2 — New Active Ingredient
“A Type 2 NDA is for a drug product that contains a new active ingredient, but not an NME. A new active ingredient includes those products whose active moiety has been previously approved or marketed in the United States, but whose particular ester, salt, or noncovalent derivative of the unmodified parent molecule has not been approved by the Agency or marketed in the United States, either alone, or as part of a combination product.”
申请Type 2 NDA,是指药品含有新的活性成分,而不是新分子。新的活性成分是指那些已经在美国市场销售或批准药品中起效的部分与之对应的特定酯、盐或非共价衍生物,而这些衍生物尚未在美国市场销售或批准。
“If the active ingredient is a single enantiomer and a racemic mixture containing that enantiomer has been previously approved by the FDA or marketed in the United States, or if the active ingredient is a racemic mixture containing an enantiomer that has been previously approved by the FDA or marketed in the United States, the NDA will be classified as a Type 2”
如果新的活性成分是单独的对映异构体,而含有这一对映异构体的消旋化合物之前已经在美国市场销售或被FDA批准;反之亦然,如果新的活性成分是消旋化合物,而之前其中的一种对映异构体已经在美国市场销售或被FDA批准;那么新的活性成分被分类为Type 2 NDA,而不是NME.
——————
下面这个氯吡格雷的例子没有涉及到Orange book里的分类,但也是和对映异构体相关的一个经典案例。
选自Top 200 Pharmaceutical Products by Worldwide Sales in 2009
在2009年的世界范围内药品销售中,紧随Liptor之后的就是右旋异构体氯吡格雷(Brand name Plavix, Generic Clopidogrel),年销售额达到9 B。氯吡格雷是由Sanofi研发,与BMY共同销售的,新一代抗凝血药物。药品于1997年在美国申请上市,FDA给予优先审批,11月17日批准上市。核心化合物专利于2012年5月17日到期,在那一天大批仿制药涌入市场。Dr Reddys的仿制药于2008年批准上市,Apotex以及另外八家公司的仿制药于2012年5月17日批准上市。是的,大家都通过简化申请(ANDA)挤在这一天上市,因为这个药太挣钱了。
Plavix是之前药物Ticlopidine(噻氯匹定)的甲酯化衍生物。Ticlopidine是由Sanofi研发的上一代抗凝血药物,但有严重的副作用,比如血小板和白细胞减少,致死率高达五分之一。所以FDA给了Black box warning。于是Sanofi继续改造优化药物结构,获得了含有Plavix的消旋混合物。但是消旋混合物在临床前实验中表现出造成实验动物惊厥的副作用。通过结晶拆分消旋混合物,Sanofi发现右旋异构体氯吡格雷不会导致惊厥。上市之后,由于药物的优异表现,市场销量连年暴涨。
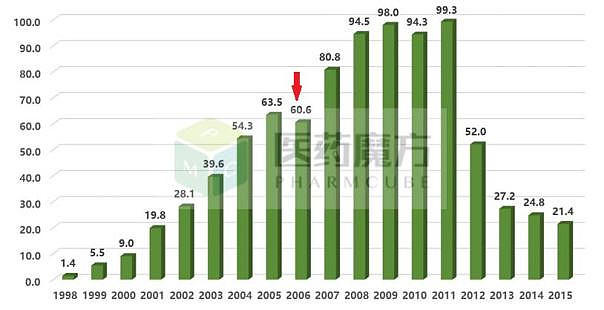
但06年的销售额却出现了一个诡异的坑,原因是蔑视专利“流氓”公司Apotex的出现。01年11月的时候,Apotex就向FDA提交了ANDA,申请仿制药上市,由于是该药物的第一个ANDA申请,FDA还会送180天的独家仿制药市场权限。Sanofi随后于2002年三月起诉Apotex侵犯其专利权。Apotex在专利界“臭名昭著”,他们保持着同时打100场官司的不光彩纪录。他们的诉讼投入几乎占研发投入的一半。Hatch-Waxman Amendments中有关于仿制药公司打专利官司的情况下,指导FDA的条文。专利持有公司起诉仿制药期间的30个月内,FDA不能批准该仿制药上市。
“Under the framework set forth in the Hatch-Waxman Amendments, a generic drug company can challenge patents covering the branded drug by filing a paragraph IV certification with its drug application and providing notice to the branded drug company and patent owner. A suit by the patent owner within 45 days of receiving the notice triggers a 30-month stay of regulatory approval, during which the U.S. Food and Drug Administration (FDA) cannot approve the generic drug. ”
由于诉讼双方坚持不下,FDA在2005年五月开始审批,2006年一月就批准了Apotex的仿制药。2006年3月,Sanofi BMY选择和Apotex庭外和解,但和解协议又被FTC否决。6月,双方达成新协议,Apotex可以在2011年销售仿制药,同时向FTC提交协议供审查。但协议里面有个漏洞,如果FTC没有批准,Apotex销售药物后,可能不必支付Sanofi BMY的三倍损失。8月初,FTC又否决了和解协议。
同年8月,Apotex不顾潜在的诉讼结果以及赔偿专利持有人巨额损失,就开始在市场上推广药物,这一行为也触发了180天的独家仿制药市场权限。Sanofi立即向法院申请禁令,法院于8月31号颁布禁令,等待专利诉讼结果。在这短短的三周之内,Apotex向市场供应了大约6个月的用量……虽然禁令禁止了Apotex继续销售,但没有把分销渠道中的药品召回。于是06年销售额出现了那个坑。
2007年6月法院判定Apotex无法证明原专利无效。Apotex的上诉结果也是维持原判。Apotex就歇了。由于Apotex在2006年销售的时候,只有不到一个月,没把180天用完。所以等到了2012年专利到期的时候,还跟FDA申请继续用那180天的市场独占权,FDA’s Pre-Launch Activities Importation Request (“PLAIR”) program,结果FDA不同意。然后Apotex就把FDA也告了。后来Apotex自觉地撤诉了。
2011年的时候,法院裁定Apotex向Sanofi BMY支付4亿美元赔偿款。
参考
科普时间:华法林之后 - 知乎 洪嘉君
氯吡格雷的专利之殇 新浪医药 医药魔方