当地时间7月21日,国际权威医学杂志《柳叶刀》发布了两款最新疫苗研发的临床试验结果。其中包括军事科学院陈薇团队和康希诺生物公司合作研发的腺病毒载体疫苗,另一款是由牛津大学和阿斯利康合作研发的mRNA疫苗。从试验结果来看,两款疫苗均取得了理想的免疫应答反应。同时美国制药公司辉瑞和德国生物技术公司BioTech也公布了他们疫苗的额外实验数据。
一、新冠疫苗各技术路线
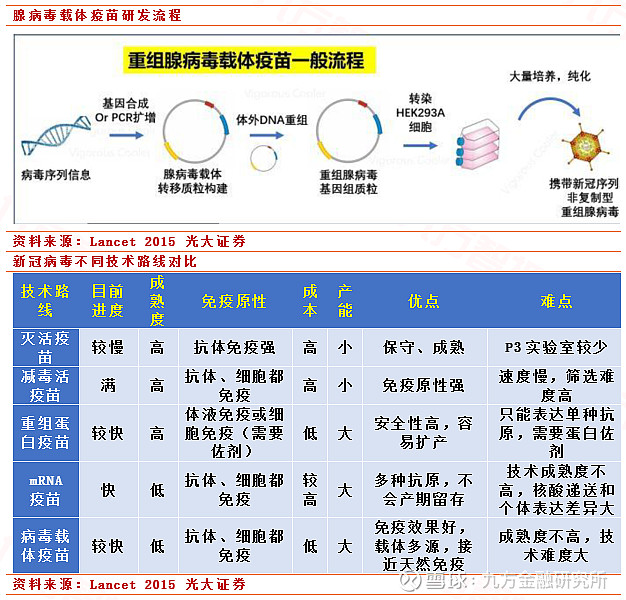
疫情发生以来,全球各地科研机构都紧锣密鼓地进行了新冠病毒疫苗研发,目前尚未有疫苗正式问世。总结来看,共有五种技术路线:灭活疫苗、减毒活疫苗、重组蛋白疫苗、mRNA疫苗以及腺病毒载体疫苗。各技术路线成熟程度不一,优劣势也区分明显。
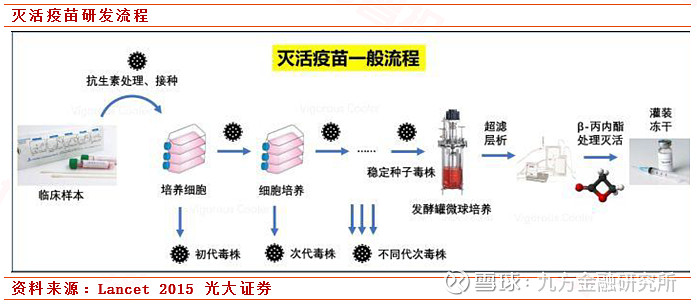
1. 灭活疫苗
相较于其他疫苗,灭活疫苗是最传统、最成熟的疫苗技术路线,其原理是通过培养免疫原性较强的病毒并通过理化的方法进行纯化来破环病毒的感染性但保留其免疫原性。其优点在于疫苗研发完成后后期生产和工艺方面能够保证产品质量的稳定性。劣势在于新冠灭活疫苗必须在P3实验室进行研发,目前国内P3实验室有限,同时容易引发高ADE表达,从而引发不良反应未知。
2. 减毒活疫苗
减毒活疫苗和灭活疫苗类似,都属于传统的疫苗技术路线,但主要方向是病毒性疫苗。减毒活疫苗是通过培养免疫原性较强的病毒,传代、低温等方法对诱变的病毒进行筛选使其毒性减弱从而成为疫苗。其优势在于相较于灭活疫苗,减毒疫苗的免疫原性更强。但在研发的过程中对环境的要求很高,往往需要在特定的条件下将毒株进行几十甚至几百次传代,因此研发周期比较漫长。
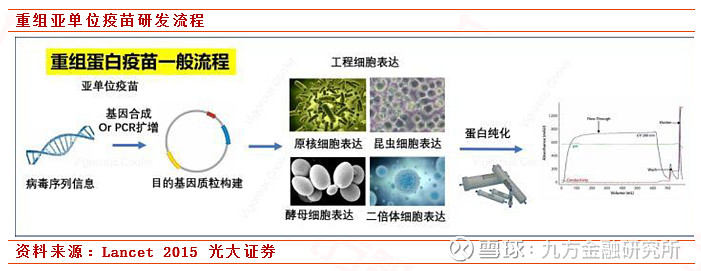
3. 重组亚单位疫苗
重组亚单位疫苗是将病毒的部分基因在基因或者细胞微生物中大量进行刻录和表达,然后经过纯化产生免疫应答。这种疫苗优势在于免疫原性较强,安全性高且技术可控,适合大规模生产。但劣势也同样不可忽视,这种疫苗需要添加额外的创新佐剂,然而目前国内并没有批准相关蛋白佐剂的使用,对外依赖性较高。
4. 核酸疫苗
与重组亚单位疫苗不同,核算疫苗(mRNA)疫苗的主要成分并不是基因微生物,而是病原体特异的mRNA或者DNA(新冠病毒就是用来和ACE2受体结合的刺突蛋白)。DNA疫苗将带有抗原基因的mRNA注入接收者的宿主细胞,从而转录出mRNA,然后翻译成抗原蛋白以便诱导免疫应答。

核算疫苗最大的优势在于无需经过毒株的筛选、隔离培养和传代的过程,研发人员可以直接利用公布的病毒序列进行制备,成本低廉,制作时间短。但限制问题也很多,比如其诱导的免疫应答一般,也需要佐剂增强免疫原性。另外,由于需要将DNA片段植入受体,一直存在隐形的安全隐患。目前全球在研的mRNA疫苗集中在BioTech、CureVac和Mordena三家公司。其中Mordena在之前的5中疫苗的一期试验中都证明了mRNA疫苗的安全性

5. 腺病毒载体疫苗
与核酸疫苗不同的是,病毒载体疫苗使用微生物而不是核酸作为载体,将保护性抗原通过重组植入微生物中,再使用这种微生物制作疫苗。常见的载体有痘苗病毒和腺病毒。此前已经有很多利用腺病毒作为载体成功上市或者正在研发的疫苗,比如埃博拉病毒疫苗。诚然,腺病毒载体疫苗基因组稳定、操作简单而且在人体内不容易发生整合,突变风险较低,疫苗抗体表达非常强烈。但在所有技术路线中,其技术难度是最高的,对于新冠病毒其成功性无法得到完全保证。
二、最新临床试验较为正面
全世界多种路线齐头并进。据统计,截至7月10日,全世界将近有20种不同路线的新冠病毒疫苗已经进入临床试验。另外还有10中疫苗进入动物试验阶段,30余个新型疫苗也处于研发阶段。
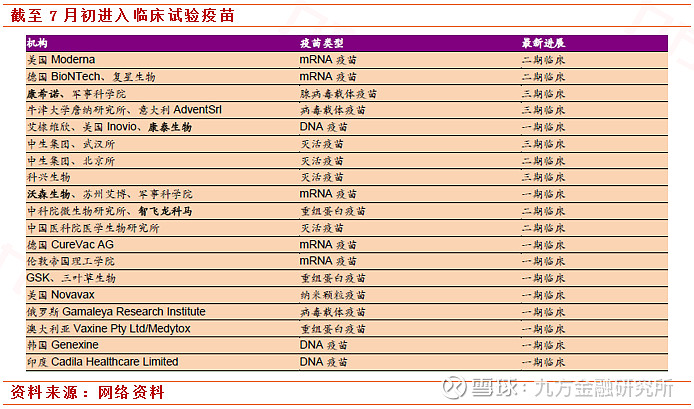
三大疫苗同时反馈较好。7月21日,康希诺生物公司(CanSino Biologics)/中国工程院陈薇院士团队,牛津大学/阿斯利康(AstraZeneca),和辉瑞(Pfizer)/BioNTech公司都公布了各自疫苗开发项目的最新结果。陈薇团队/康希诺生物和牛津大学/阿斯利康在著名医学期刊《柳叶刀》上分别发布了2期临床和1/2期临床试验的结果。而辉瑞/BioNTech公司则在medRxiv上发布了mRNA新冠疫苗的1期临床试验的进一步结果。这些最新临床结果除了汇报在研新冠疫苗激发中和抗体免疫反应以外,描述了疫苗激发的T细胞免疫反应。T细胞免疫反应是人体清除病毒感染的重要手段之一。
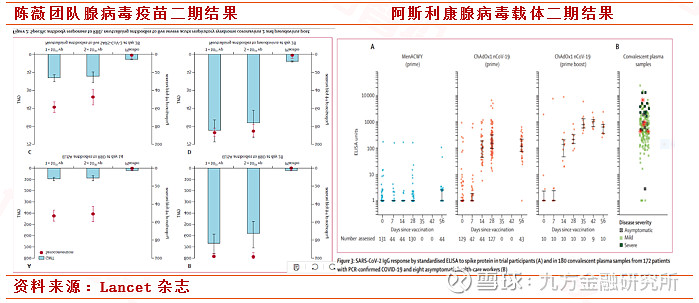
中国工程院陈薇院士团队和康希诺生物公司联合开发的新冠病毒疫苗使用无法复制的Ad5腺病毒载体表达新冠病毒的刺突蛋白(S protein)。在这项2期临床试验中,总计508名参与者接受了一次新冠疫苗。试验结果表明,在接受一次疫苗接种之后第28天,96%(高剂量组)和97%(低剂量组)的志愿者产生能够与S蛋白受体结合域(RBD)结合的抗体,ELISA检测的峰值分别为656.5和571.0。
同日,阿斯利康联合宣布,由牛津大学(Oxford University)领导的正在进行的1/2期临床试验COV001的中期结果显示,在所有接受评估的参与者中,新冠病毒疫苗ChAdOx1 nCoV-19均可耐受并产生针对新冠病毒的抗体和细胞免疫应答。试验结果表明,在接受一剂ChAdOx1 nCoV-19接种的志愿者中,与针对新冠病毒刺突蛋白的抗体水平在接种后第28天达到峰值,并且在接种后56天仍然维持在高水平。在两次接种疫苗的志愿者中,针对刺突蛋白的抗体水平显著高于接种一次疫苗的志愿者。
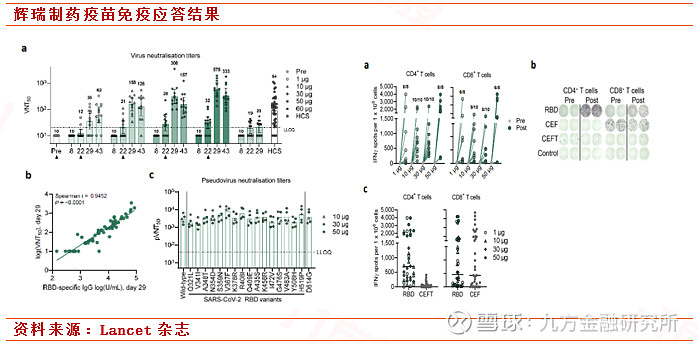
21日,辉瑞公司和BioNTech公司宣布了双方共同开发的mRNA新冠疫苗BNT162b1在德国进行的1/2期、开放标签、非随机、非安慰剂对照、剂量递增试验的初步数据。试验结果表明,在第二次接种后,疫苗产生剂量依赖性高水平的新冠病毒中和抗体。接种后第43天时,接受剂量为50 µg的疫苗接种的志愿者血清中的中和抗体滴度达到COVID-19恢复期患者的3倍以上。而且,这些中和抗体能够对多种新冠病毒变体产生中和作用,包括最近在世界范围广泛流行的D614G毒株。
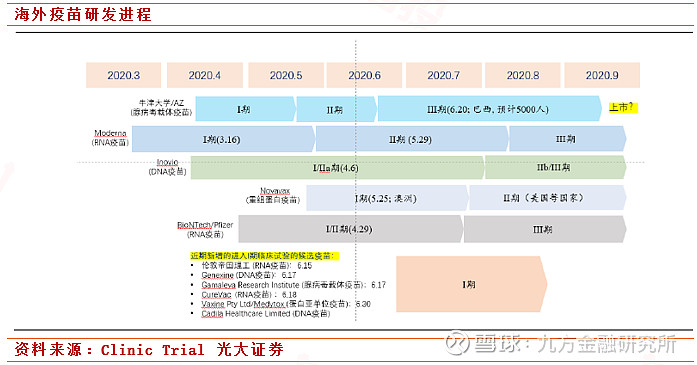
Mordena登上疫苗研发快班车。今年2月,Moderna称公司用于预防新冠病毒感染的mRNA疫苗研发工作取得阶段性胜利;今年3月,Moderna称美国食品药品监督管理局(FDA)已完成对该公司研制的新型冠状病毒mRNA疫苗——“mRNA-1273”的审查,批准其进入临床试验;公司将于7月27日动大规模三期临床试验,拟招募3万受试者。
三、疫苗市场空间及公司
中美英竞争格局激烈。纵观全球疫苗研发格局,目前全球有超过150种可能的疫苗正处于研发和试验的进程中,其中,有23种新冠肺炎候选疫苗处于临床研发阶段,中美英三个国家的疫苗项目都开始步入了冲刺阶段,研发阵营已显现分化之势,其竞争的白热程度十分激烈。
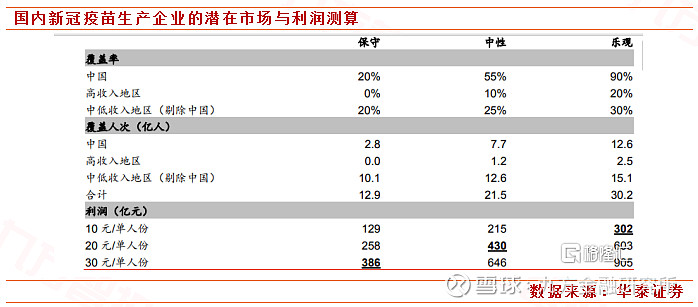
国内空间测算。产能方面,目前国内产能最多能达到1亿试剂,任何单家公司都无法承担如此的需求。如果按照国内情况来类比的话,假设国内最终接种疫苗达到9亿人口且疫苗上市后单价达到80-100元/份;国内企业研发成本和净利润水平平均委30%;最终国内有10家企业供应市场;初步测算国内市场容量为720亿,每家企业销售额达到72亿,对应每家企业市场空间再240-300亿之间。
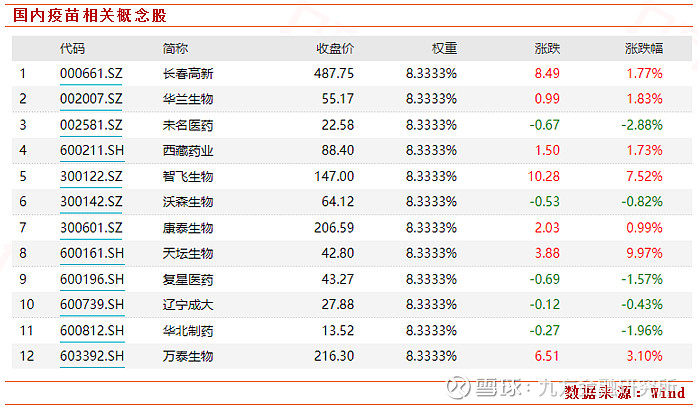
具体公司方面,由于21日利好消息,今日早盘生物疫苗板块表现活跃,截至发稿,君正集团、海利生物涨停,西藏药业涨超8%,智飞生物、康华生物涨超7%,万泰生物、人福医药等纷纷跟涨。截至收盘疫苗指数上涨1.64%至3040.12点。
投资机会方面,建议关注:美年健康、健康元、万孚生物、基蛋生物、鱼跃医疗、大博医疗、凯利泰、迈克生物、凯莱英、泰格医药、富祥股份、普洛药业等。
$美年健康(SZ002044)$ $健康元(SH600380)$ $万孚生物(SZ300482)$
参考文献:
20200719-光大证券-光大证券疫苗行业深度报告之二(技术与产品篇)暨新冠疫情系列报告之四:疫苗投资的“寻宝地图”
2020721-川财证券-川财证券医药生物行业日报:多款新冠疫苗发表临床实验数据
本报告由九方智投投资顾问刘欣(登记编号:A0740620060001)撰写
更多精彩文章,可关注雪球号:九方金融研究所,获得更多独家实用的观点! @今日话题