我一直以来尊敬 Stevevai1983 ,认为他通晓欧美各国律法和政策。
那么,K药(keytruda)究竟是不是美国孤儿药呢?
美国东部时间2014年9月4日(北京时间9月5日),Keytruda(Pembrolizumab)通过了美国食品药品监督管理局(FDA)的加速审批,用于其他药物治疗无效的晚期或不能手术的黑色素瘤。
在美国,约有5%的新发癌症是黑色素瘤。根据美国国家癌症研究所(NCI)的数据,美国每年有76100人被诊断患有黑色素瘤,其中有9710人死于该疾病。
Keytruda是第一个获得上市批准的可以阻碍PD-1的药物,FDA当时认为: Keytruda需要在Ipilimumab(伊匹单抗)后使用。对于表达BRAFV600基因突变的黑色素瘤患者,Keytruda也需要在Ipilimumab(伊匹单抗)和一种BRAF抑制剂治疗后使用,BRAF抑制剂是一种阻断BRAF基因突变效应的药物。
FDA之前批准的五个黑色素瘤药物分别是:Ipilimumab(伊匹单抗)(2011年)、聚乙二醇干扰素α-2b(2011年)、Vemurafenib(维罗非尼)(2011年)、Dabrafenib(达拉菲尼)(2013年)、Trametinib(曲美替尼)(2013年)。
根据证据表明:相比现有药物, Keytruda可能实质性地提高治疗效果,基于此FDA授予了Keytruda突破性疗法认定。Keytruda同时还获得了优先评审以及孤儿药认定。获得优先评审资格的药物需要满足的条件是:在上市申请提交时,该药物可能显著提高某种严重疾病治疗的安全性和有效性;而孤儿药认定则被授予那些旨在治疗罕见病的药物。
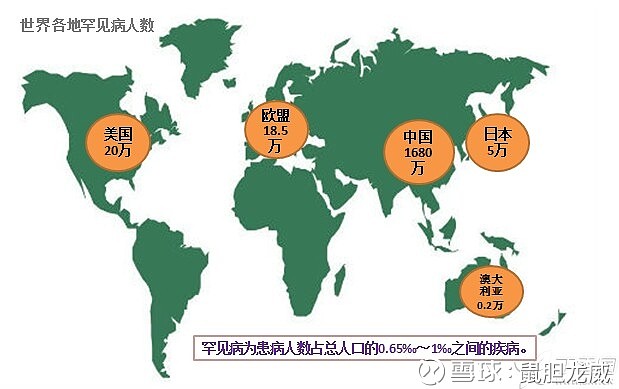
根据美国孤儿药定义,患病人数小于20万, FDA可以认定为孤儿药。

虽然,美国黑色素瘤患者总人数超过了20万,但是需要注意: 由默沙东开发的 Keytruda ,2012年11月19日被授予孤儿药称号(审评进程中),2014年9月4日正式获批为孤儿药。
原因是该药FDA批准上市的适应症人群为:不可手术切除或者转移性黑色素瘤( 其他药物治疗无效的晚期黑色素瘤 )。 这一类晚期黑色素瘤患者人群,远远小于20万。(每年美国有 9710人死于 黑色素瘤 )
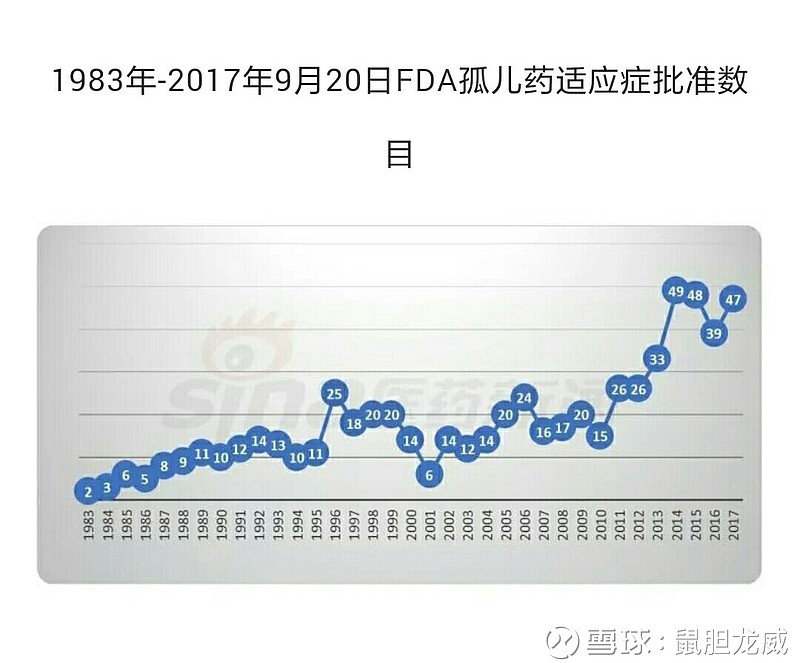
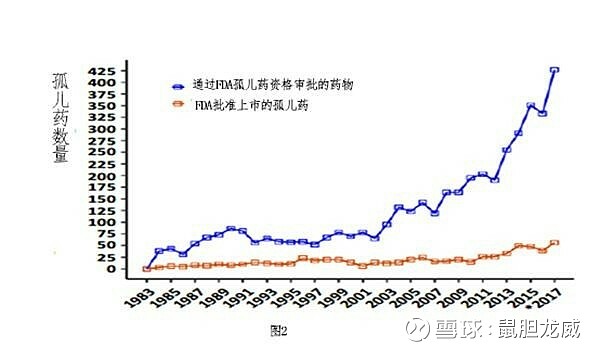
所以,朋友们可以看见美国FDA近年批准了400+种孤儿药。

所以,也有预测认为 :2022年 全球孤儿药市场将超过200亿美元。
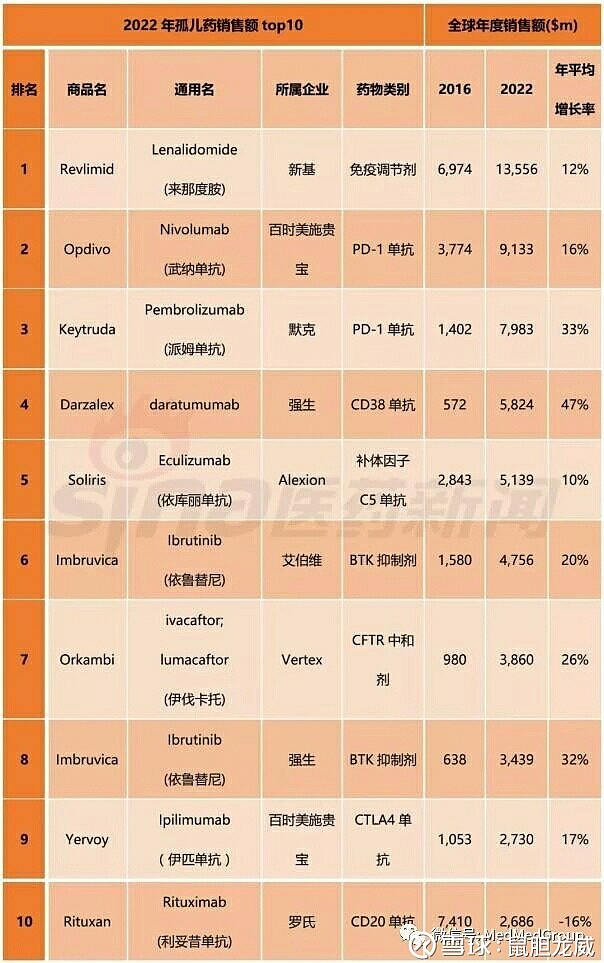
根据 EvaluatePharma预测:K药作为孤儿药,2022年销售额将高达79亿美元,仅次于O药和来那度胺。
所有证据已经表明:K药的确是美国FDA认定的孤儿药。
@今日话题
全部讨论
老师,首先请注意休息,其次面对某些冷嘲热讽请无视,愿你开心健康每一天。
双鹭药业来那度胺(立生)海外市场前景浅谈(重点在第5节)
(1)$双鹭药业(SZ002038)$ 来那度胺(立生)晶型与$新基制药(CELG)$ 来那度胺(瑞复美)晶型不同,可以挑战新基专利。
(2) 180天市场独占期的两个条件:①最早提交ANDA(First to file),可以是多家企业 ②Para IV声明。
180天这一条款,是由FDA执行的保护性条款,自第一次申请人首次销售仿制药之日起180天,不批准其他仿制药上市。
Para IV声明:
该专利无效;
或该专利不会因为其他药企制造、使用、销售而提交新药上市申请,而受到侵犯。
此外还有:
Para (I)该专利信息尚未提交,
Para(II)该专利已过期,
Para (III)该专利将过期的日期。
(3)上文什么意思呢?
也就是说,①与新基制药晶型专利完全相同,享受180天市场独占期(与新基制药在2024年共享)。
双鹭药业显然属于第二种情况,②与新基制药晶型专利不同, 假如制造、使用、销售提交“立生”上市申请,不会侵犯“瑞复美”的专利。
这种情形下,又分为如下两种背景:
【1】立生2019年(或者202?年)在美国上市,将与瑞复美共享美国市场至2024年。
因为“立生”晶型专利的确认(2029年到期),并不能否定“瑞复美”晶型专利的有效期(2024年到期)。
美国市场来那度胺2017年销量357亿人民币(54亿美元)。
那么进入第一年,就有可能在美国销售大于100亿人民币……直到2024年。
【2】立生2024年初上市,2024年下半年才有第二个仿制药在美国上市。
因为有机构预测2024年来那度胺全球销售787亿人民币(119亿美元)。
那么,立生可能180天内就销售200亿人民币。
(4)美国以外规范市场(欧洲、日本),仍然有27亿美元销售额,双鹭药业与新基制药争夺海外市场,并不受180天条款制约。
(5)有没有其他上市路径?
刚才说的,是按照NDA上市途径:505(b)(1)途径申请上市。
还有一种上市途径,就是采取505(b)(2)途径申请上市。
这种途径也来自于 《药品价格竞争和专利期恢复法》(“Hatch-Waxman修正案”)。
根据1984年Hatch-Waxman修正案确立的505(b)(2)许可途径,允许申办者部分依赖已发表的文献和并非由申办者开展的研究,用于支持所申请项目的安全性和有效性。引入这个途径的目的是避免不必要的重复研究,尽量减少为获得FDA批件而浪费的时间和金钱。
505(b)(2)途径对生产商越来越有吸引力,可以说是全新505(b)(1)申请与简略新药申请(ANDA)的中间路径。这个途径可以缩短开发时间和费用,还能获得3∼5年的市场专有权,而不像仿制药只有180天的专有权。该路径也适用于孤儿药或儿童用药。
自2002年以来,通过505(b)(2)批准的申请稳步增长,而505(b)(1)批准的申请有所下降。
505(b)(2)申请适用于多种产品,其适用于5类药物:一是新适应症;二是含有先前已批准活性成分的新组合;三是新制剂或新生产商;四是剂型、规格、给药途径或给药方案变化;五是活性成分(例如不同的盐)变化,或更高数量的活性成分。
比如,双鹭药业可以生产一种(立生+地塞米松)复方制剂。这就可以采用 505(b)(2)途径。
@水里望月 @willstar1976 @生煎只爱大壶春 @天外飞仙闯股海 @妖妖能赚钱 @金头和小狐狸的麻麻 @wills11 @萌萌的虫虫 @低调的鹭鹭
附图:美国NDA上市路径。
牛大请继续,也请无视那些没水平,也不懂股市,亏了钱就想找个替罪羊来替自己的无能解脱和解释的傻韭菜们,没有他们,还没人给咱们送钱呢是不是。
谢一直以来的无私分享。一个品质高尚,高贵的好球友
牛董辛苦了!一路相伴,一路追随,一路走来,一路精彩
严谨,专业,真想挨个@ 那些昨晚在我评论下面那些喷子们,想想还是算了,懒得和他们说话,只知道一味的瞎喷。牛董还是那个牛董,但某s可能不一定是那个某s了。
先报个到,只是觉得牛总那么牛逼的号不用了有点太可惜了
下午看到唐朝说被禁言,然后取消禁言时要自己删帖消号了






