近期,CDE发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》的征求意见稿,进一步明确药物研发应以患者需求为核心,以临床价值为导向。

这份指导原则毫无疑问体现了监管部门对抗肿瘤新药开发的新要求、新标准和新趋势。首先,强调以患者需求为导向。恶性肿瘤的致病机制复杂,企业应加强肿瘤发生、发展以及药物作用机制的研究,解决患者的实际问题。其次,关注临床治疗需求的动态变化。随着众多新机制药物、新技术疗法的上市,患者的临床需求也在发生动态变化。创新药应当是立足真正的未满足需求,提高疾病治疗效果、改善药物安全性以及治疗的便利性和顺应性等治疗体验。
如果说以上两点还只是各家企业自行领会的文件精神,那对于“临床对照药选择”的明文解释可以说是监管机构的直接态度,也是企业后续不得不考虑的新药开发门槛。该原则明确指出:1)不能基于提高临床试验成功率和试验效率的目的,选择已被更优的药物所替代的治疗手段。2)明确抗肿瘤药物单臂研究的适用范围,只适合在无标准治疗可选择的末线患者中开展,并且只有疗效突出的药物才适合采用单臂临床试验。
新药研发的最高目标是为患者提供更优的治疗选择,如果没有选择最优的疗法作为对照,即使临床试验成功也无法证明该药物对患者的价值。CDE此份指导原则无疑会对创新药的开发产生深远影响。业界普遍认为将会对当前we -too的创新药研发格局造成洗牌效应,倒逼企业从源头创新的角度解决同质化创新药扎堆的问题。
转向源头创新,倒不是寄望国内的创新药企业一夜之间就全去做first in class,这既不现实也不科学,或者也显得盲目,但至少可以在更早期就以“满足临床需求、体现临床价值”的目标来筛选评估进入人体临床试验阶段的候选药物,而不仅仅只是为了药物的商业上市而做一些“改个结构规避专利”的药物,这样做出具有“疗效或/安全性优势”的me better新药的可能性也更高。
当然,做me better/best并不容易,尤其是传统的体外酶学和细胞活性测试很难准确表征一个项目的临床价值。在当前形势下,更有效率以及更有前瞻性的药物发现、筛选和评价体系会成为一家公司的主要竞争力。而中国创新药的行业基础,结合中国的国情,也决定了我们不能照搬欧美创新药企业的成长路径,而应该多条腿走路。举一个百奥赛图通过动物体内药效筛选评价抗体药物的例子,供大家参考。
百奥赛图:创新候选药物筛选模式
提起百奥赛图,大家最耳熟能详的可能就是其在2020年初提出的雄心勃勃的“千鼠万抗”计划。这家2008年成立的公司,围绕实验小鼠进行了两次业务模式跃迁。从最早期的基因编辑定制化服务,到2015年转型为基因编辑动物模型的生产供应商以及提供临床前研究服务的CRO公司,再到2019年全人抗体系列小鼠模型(RenMiceTM)研发成功后,开始旗帜鲜明地转型成为一家生物技术和创新药Pipeline公司。
在这个过程中,百奥赛图将创立十余年来打造bmy的全人抗体系列小鼠模型(RenMiceTM)、单细胞抗体发现技术平台、基因编辑模型制备平台、规模化的动物繁殖与供应平台和动物体内药效评价平台等整合在一起,结合2016年底设立的专注于推进自身新药项目开发的祐和医药,从而建立了覆盖从靶点验证、全人抗体快速开发、动物体内外药理药效评价、IND临床申报到临床开发的全流程抗体新药研发体系。这个体系是百奥赛图转型为Biotech公司以及筛选搭建创新药产品管线的条件基础,也是其推进“千鼠万抗”计划的技术支撑。
目前,百奥赛图已经构建了一条由10多款肿瘤和感染疾病药物组成的创新产品管线,涉及10多个靶点,药物类型包括单克隆抗体、双特异性抗体、ADC药物,以及双特异性抗体-ADC等,并且高效推进这些项目的临床开发。
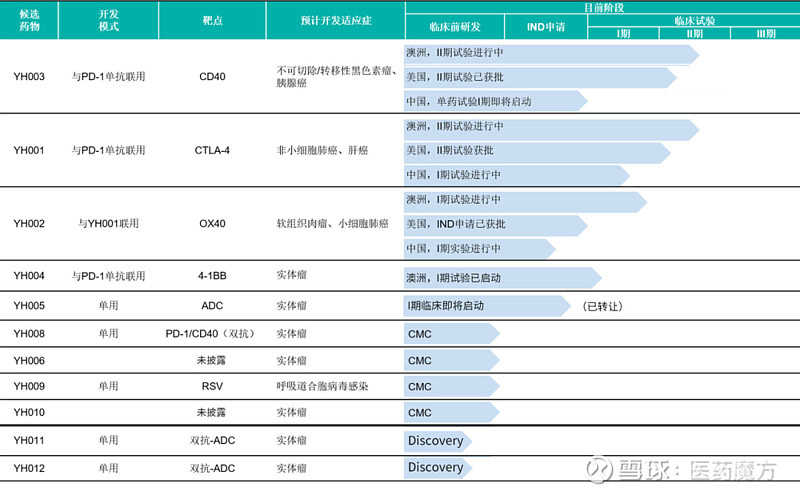
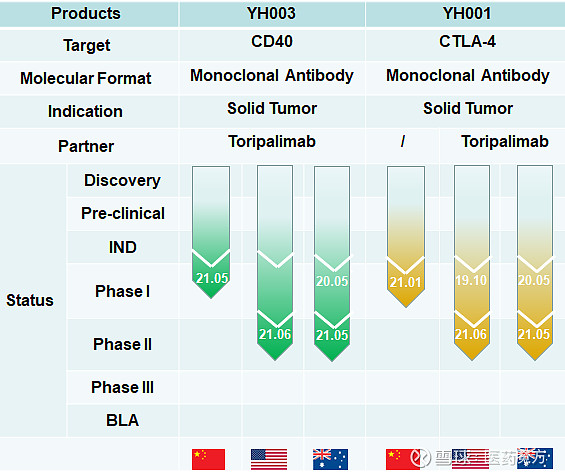
6月29日,百奥赛图YH001(CTLA4)、YH003(CD40)的美国II期IND双双获得FDA批准,印证了百奥赛图抗体药物早期发现、抗体分子筛选和临床开发方面的能力。
相比于传统的体外大量细胞活性检测确定先导分子,再通过动物体内药效确认先导分子的筛选方法,百奥赛图使用动物模型进行大规模的体内药效评价和潜力项目筛选,结合基因编辑、体内靶标敲除验证,为药物作用机制、耐药机制的研究提供证据。以动物体内药效数据作为依据,通过大规模的体内药效筛选确定出可以进入临床开发的项目,不失为一种更直接高效的抗体开发方法,筛选出的抗体分子也就更有临床开发前景和价值潜力。下面也以其开发进度最快的YH001和YH003为例作一简单介绍。
YH001/YH003:安全性优势突出,
拓展PD-1联用空间
YH001是一款靶向CTLA-4的单克隆抗体。CTLA-4和PD-1被认为是免疫系统的两个重要检查点,分别通过影响不同类型的T细胞来启动抗肿瘤免疫攻击,被认为是肿瘤免疫治疗的基石靶点。BMS的伊匹木单抗(CTLA4)联合纳武利尤单抗(PD-1)已经在多个实体瘤中获得批准,默沙东也在全球开展K药与CTLA-4单抗quavonlimab(与康方生物联合开发)固定剂量一线治疗晚期肾透明细胞癌(ccRCC)的临床研究。
不过,接受伊匹木单抗(或其它CTLA-4单抗)单药治疗或者与PD-1单抗联合治疗的患者,再临床试验中都有不同比例的3级和4级不良事件发生,包括免疫介导的肝炎和肝毒性、肺炎、结肠炎、甲亢等,甚至因不良反应而导致治疗停止。可以说,CTLA-4单抗的安全性限制了CTLA-4与PD-1联合的临床使用与拓展。
YH001是百奥赛图依托自主开发的动物模型,通过对大量候选抗体分子进行大规模动物体内药效评价,并基于动物体内药效和安全性数据筛选得到最优抗体分子,然后进行一系列体外研究和安全性评价后推向临床。临床早期数据已显示出了明显的临床优势,也说明了百奥赛图在临床前通过动物体内药效筛选“best in class”和“first in class”药物分子的模式得到了初步验证。
AACR2020会议公布的临床前数据显示,YH001+帕博利珠单抗优于伊匹木单抗+帕博利珠单抗;同时,联合治疗也未造成动物体重的波动或降低,这在一定程度上体现了药物的耐受性和安全性潜力。
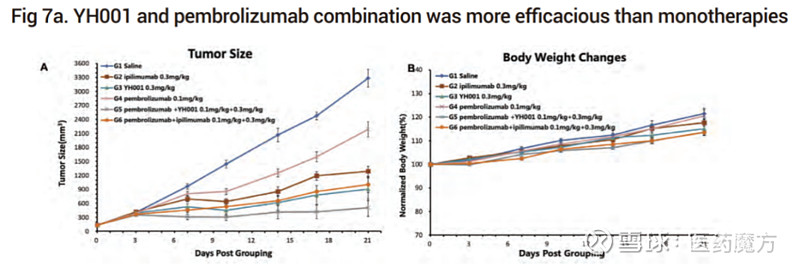
来源:AACR2020
在ASCO2021会议上,百奥赛图公布了YH001联合特瑞普利单抗治疗晚期实体瘤的安全性、耐受性和药代动力学的澳洲Ⅰ期剂量爬坡研究初步结果,7例可评估患者中有4例达到SD;截止至2021年3月1日,1例患者(GEJ)实现PR,靶病灶较基线缩小至60.9%。在已经完成的3个剂量组(0.05、0.1和0.3mg/kg)中,YH001联合特瑞普利单抗显示了十分出色的安全性数据,未发现免疫介导的肝炎和肝毒性、肺炎等严重不良事件,其他多数不良事件均为1级,研究未发现≥3级不良事件、未观察到剂量限制性毒性(DLT)、未报告严重不良事件(SAES)或不良事件导致的治疗中断。YH001的安全性优势无疑是会拓展CTLA4+PD1组合的临床应用空间。
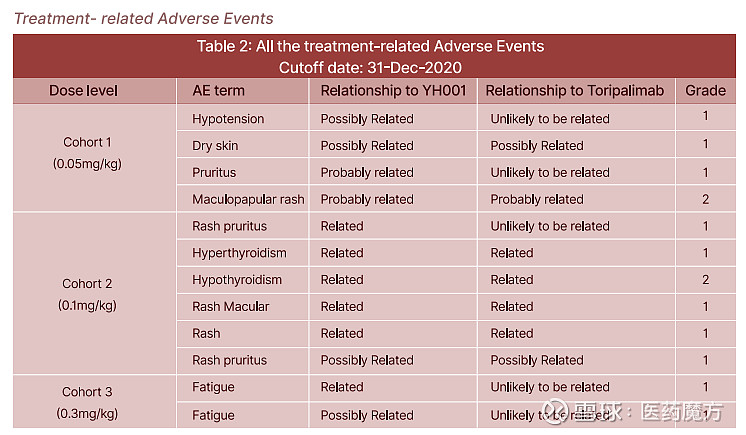
来源:ASCO2021
YH003是一款靶向CD40的抗体激动剂,同样是百奥赛图通过动物体内药效评价筛选出来的潜力分子。CD40激动剂可以将“冷肿瘤”转化成“热肿瘤”,也可以与肿瘤免疫药物(如PD-1)联用,增强免疫应答,是非常有前景的药物靶点。但对于激动剂的开发,安全性一直是影响成药前景的主要因素。
AACR2020会议公布的临床前数据显示,YH003与PD-1联用在B16F10(小鼠黑色素瘤)和MC38(小鼠结直肠癌)人源化小鼠模型中,显示良好抗肿瘤疗效。同时,YH003与罗氏CD40抗体Selicrelumab相比,肝脏安全性显著提高。相同剂量下,YH003未造成ALT/AST水平的显著升高。即使在21天时,YH003 30mg/kg造成AST水平升高,也仅与Selicrelumab 3mg/kg造成的AST升高水平相当,无疑显示更宽的治疗窗。

来源:AACR2020
ASCO2021会议公布的I期数据显示YH003同样具有出色的安全性和成药潜力。该I期研究主要评估YH003+特瑞普利单抗在晚期实体瘤患者中的安全性、耐受性、药代动力学特征及初步的抗肿瘤疗效。结果显示,与治疗相关的不良事件主要是脉络膜增厚、乏力和发热,多数均≤3级,仅1例3级药物相关不良事件,1例导致停药的不良事件,未观察到剂量限制性毒性(DLT)事件,无因AE导致的死亡。
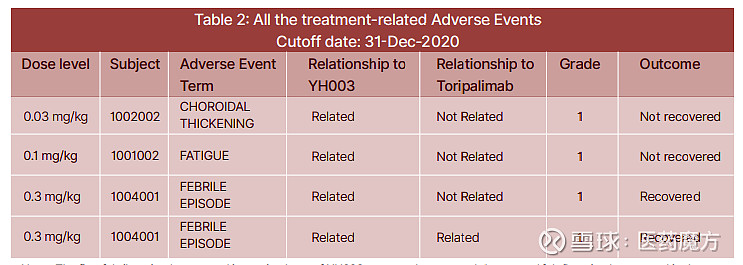

来源:ASCO2021
有效性方面,5例此前接受PD-1/L1治疗失败的患者中有2例实现疾病稳定(SD),1例接受PD-1/CTLA4联合治疗复发的眼睛黑色素瘤患者实现部分缓解(PR)。
针对接受PD-1、PD-1/CTLA4联合治疗复发的肿瘤患者,YH003达到疾病控制,显示出了满足临床需求的潜力。这也符合《以临床价值为导向的抗肿瘤药物临床研发指导原则》中要求的关注治疗需求动态变化,寻找克服耐药的新一代抗肿瘤新药的要求不谋而合。
以YH001和YH003为例可以看出,百奥赛图这种通过体内药效评价筛选潜在临床优势的创新药物分子(evidenced based)正是其药物研发体系的核心和精髓。百奥赛图2020年提出“千鼠万抗”计划,在未来3~5年内,通过全人抗体小鼠RenMab对1000多个潜在抗体靶点完成验证,通过大规模动物体内药效进行评价,寻找潜在“first in class”的靶点和药物分子。
临床开发:优质项目与实力团队相辅相成
以临床价值为导向开发抗肿瘤药物,除了要求项目本身具有潜在的疗效和安全性优势,也要求一个公司的临床开发团队对临床需求、药物的潜在使用场景有充分的认知,否则就无法制定具有差异化竞争优势的临床开发策略,实施高质量的临床研究方案,无论前期筛选到的候选药物多么有潜力,在临床开发环节也会被浪费。
YH001和YH003均是2020年5月首次开展临床研究。2021年6月29日,百奥赛图/祐和医药宣布YH001和YH003的II期临床试验获得美国FDA批准。2020年开始全球新冠疫情肆虐,百奥赛图用一年时间将两款药物均推进至Ⅱ期临床阶段,而且还是中美澳三地同步进行,开发速度和效率还是很高的。
祐和医药作为百奥赛图的全资子公司,负责百奥赛图新药项目的临床开发,虽然成立时间不算长,但临床开发团队的整体实力是比较出众的。首席医学官陈兆荣博士从事医药研发30余年,具备医学研究、各期药物研发、药物审评和注册等工作经验,曾在澳大利亚药品管理局从事药物审评与审批工作,并在GSK、赛诺菲、拜耳先灵等著名药企担任临床医学部门负责人。首席注册及策略官李志宏博士曾担任美国FDA资深审查员,并曾在辉瑞从事临床研究。首席运营官Sabrina Wang曾担任IQVIA BDU 负责人,并在精鼎医药(PAREXEL)担任商业开发部中国区负责人和临床运营高级总监兼大客户管理高级总监等职务,具有15年以上的临床运营经验。
百奥赛图的临床开发团队在中美澳三地拥有较好的临床试验资源,同时也具备全球性的药物开发经验。目前,YH003是国内第一家进入II期的CD40抗体,与PD-1抗体的联用研究在全球处于第一梯队。YH001是国产创新性CTLA-4抗体与PD-1联用第一个进入到Ⅱ期的研究药物。
另一方面,YH001和YH003之所以临床进展迅速也与其临床开发策略和临床方案设计息息相关。特别是考虑药物最终临床使用场景,以及各国监管机构对临床方案的接受程度,再制定适应性的临床开发策略和方案。
以CTLA-4抗体YH001为例:YH001联用PD-1抗体也极有可能成为最终的临床选择。因此,YH001在澳洲开展的临床I期研究,并没有循规蹈矩的仅开展YH001单药研究,而是把YH001与PD-1抗体的联用融入到澳洲I期临床研究中,这是基于澳洲临床监管政策和临床治疗实际而做出的灵活有利的应对。
因此,2020年5月,百奥赛图与君实生物达成战略合作,开展YH001联合特瑞普利单抗的临床研究,以评估联合治疗的安全性和有效性。同时,基于澳洲I期临床研究的初步数据,迅速开展YH001单药在国内的I期研究,验证单药的安全性和有效性,从而为YH001更为广泛的联合用药方案,特别是与PD-1联用打下坚实的基础。
可以看出,百奥赛图在澳洲和中国采取了不同的临床策略,在一年的时间内通过联用和单药,既证明了药物的安全性,同时又兼顾了未来II/III期研究的需要,以及潜在的商业化合作可能。YH001迅速实现临床开发的“弯道超车”,无论是临床数据还是临床速度,都是国内药企竞争者中的佼佼者,呈现出药物发现和临床开发“老司机”般的纯熟,为后续的发展赢得了先机。
结语
以临床价值为导向的抗肿瘤药物开发,首先是对进入临床开发的候选药物分子提出更高的“潜力”要求,即便是follow同样的靶点,也要有弥补其他同类药物缺陷或不足的差异化优势。其次是要求动态把握患者的治疗需求,做出贴合患者用药场景的试验方案。临床试验是新药开发的必经阶段,第一位的目标是为了验证新药的临床价值,而不应是把获得支持一个药物商业化上市的数据证据作为试验开展的第一出发点。
总之,虽然大量同质化的Me too创新药造成了一定程度的资源浪费,是过去5年中国创新药可及性的提升也是肉眼可见,这或许也是我国创新药产业发展的必经阶段。CDE此次发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》,更大的意义是进一步明确创新的方向,引导企业和资本真正关注临床需求。