2024 ASCO:国产双抗有哪些动态更新?
原创 凯莱英医药 2024-05-12 07:26 北京
2024年ASCO大会将于5月31日-6月4日美国伊利诺伊州芝加哥举行。相比往年,2024 年 ASCO 年会提供了更为丰富、数量更多的学术会议盛宴。据官方统计,本次 ASCO 年会预计开展场次超 200 场,涵盖:24 场口头摘要专场(Oral Abstract Session)、24 场摘要速递专场(Rapid Abstract Session)、超 250 项口头摘要汇报,16 场临床科学研讨会(Clinical Science Symposium),超 2000 篇壁报展示。
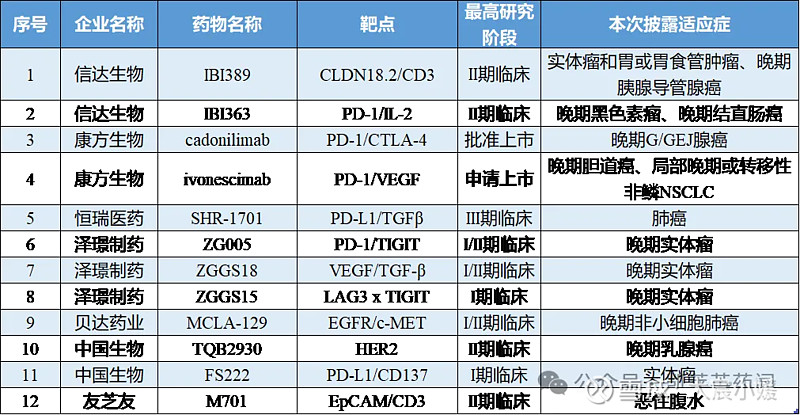
据不完全统计,本次中国药企在会议中展示的药物类型涵盖小分子药、单抗、双抗、抗体偶联药物(ADC)、CAR-T、PROTAC等,其中有7家企业预计将于本次会议中,展示其相关双抗药物的最新临床动态。
国产双抗即将披露的临床动态
一
信达生物是一家致力于研发、生产和销售肿瘤、自身免疫、代谢及心血管、眼科等重大疾病领域创新药物的生物制药公司,将在本次会议上公布约20项最新临床研究数据,包括公司旗下一系列单抗、双抗及ADC在研管线,及达伯舒®(信迪利单抗注射液)、耐立克®(奥雷巴替尼)、他雷替尼(ROS1抑制剂)等创新肿瘤药物。
1、IBI389
IBI389是公司自主研发的一种抗CLDN18.2的T细胞衔接双特异性抗体,通过连接T细胞受体复合体中的CD3和肿瘤细胞表面的CLDN18.2抗原,诱导免疫突触形成,刺激T细胞活化,促进细胞溶解蛋白的产生、炎性细胞因子的释放和T细胞进一步增殖,从而达到持续杀伤肿瘤细胞控制肿瘤生长的目的。
根据2024 AACR披露的数据,采用单细胞RNA测序和流式细胞术检测PDX小鼠模型的肿瘤免疫反应,以揭示STING激动剂ADU-S100优化IBI389作用的潜在分子机制。结果显示:在胰腺导管腺癌(PDAC)类器官中,IBI389诱导了强效的特异性细胞毒性,CLDN18.2抗体在体外的类器官-免疫共培养模型中促进CD3+T细胞与肿瘤细胞结合,从而形成了免疫突触(IS)。此外,IBI389单药治疗可以明显抑制小鼠模型中的肿瘤生长,并提高体内存活率;STING激动剂ADU-S100在体内外可显著诱导TCF1+PD-1+干细胞样CD8+T细胞的富集,从而增强IBI389的治疗效果。除此之外,研究在IBI389联合ADU-S100治疗的PDX小鼠模型和hCD3e KPC小鼠模型中,观察到了更多的TCF1+PD-1+干细胞样CD8+T细胞、CD4+CD127+记忆T细胞、CD8+CD127+记忆T细胞,而CD4+PD-1+Tim-3+耗竭T细胞、CD8+PD-1+Tim-3+耗竭T细胞和CD4+CD25+Treg细胞数目相对较少。
2、IBI363
IBI363 是公司自主研发的PD-1/IL-2双特异性抗体融合蛋白,IL-2臂采用α-biased设计,在提高疗效的同时降低IL-2相关毒性,而PD-1结合臂可以实现对PD-1的阻断和IL-2的选择性递送。因此,IBI363具有同时阻断PD-1/PD-L1通路和激活IL-2通路两项功能,可以更精确和有效地实现对肿瘤特异性T细胞的靶向和激活。IBI363不仅在多种荷瘤药理学模型中展现出了良好抗肿瘤活性,在PD-1耐药和转移模型中也表现出了突出的抑瘤效力。同时,在临床前模型中,IBI363安全性特征良好,整体安全性可控。目前,IBI363正在中国和澳大利亚进行临床I期研究,以评估IBI363在晚期实体瘤或淋巴瘤受试者中安全性、耐受性和初步有效性。
二
康方生物打造了独有的端对端康方全方位新药研究开发平台(ACE Platform),建立了以Tetrabody双特异性抗体开发技术、抗体偶联(ADC)技术平台、mRNA技术平台及细胞治疗技术为核心的研发创新体系,国际化标准的GMP生产体系和运作模式先进的商业化体系,成为了在全球范围内具有竞争力的生物医药创新公司。
1、Cadonilimab(卡度尼利)
卡度尼利是公司自主研发的全球首创PD-1/CTLA-4双特异性肿瘤免疫治疗药物,已于2022年6月29日获得国家药品监督管理局的批准,用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。该药物是世界上第一个肿瘤免疫治疗双抗新药,也是中国的第一个双特异性抗体新药。
卡度尼利主要被开发用于治疗胃癌、肝癌、肺癌、宫颈癌、胰腺癌、食管鳞癌等多种恶性肿瘤。相关临床研究数据显示,卡度尼利与PD-1单抗联合CTLA-4单抗的联合疗法相比,毒性显著降低,具有明显的安全性和疗效优势。目前,卡度尼利加含铂化疗联合/不联合贝伐珠单抗一线治疗持续、复发或转移性宫颈癌的新药上市申请,以及卡度尼利联合化疗一线治疗晚期胃或胃食管结合部腺癌的新药上市许可申请,均已被CDE受理。
2、Ivonescimab(依沃西)
依沃西是公司自主研发的全球首创PD-1/VEGF双特异性抗体新药,基于独特的Tetrabody技术设计,可阻断PD-1与PD-L1和PD-L2的结合,并同时阻断VEGF与VEGF受体的结合。PD-1抗体与VEGF阻断剂的联合疗法已在多种瘤种(非小细胞肺癌、肾细胞癌和肝细胞癌)中显示出强大的疗效。鉴于VEGF和PD-1在肿瘤微环境中的共表达,与联合疗法相比ivonescimab作为单一药物同时阻断这两个靶点,可能会更有效地阻断这两个通路,从而增强抗肿瘤活性。
2022年12月,ivonescimab以总交易额高达50亿美金(5亿美金首付款),外加销售净额两位数提成的合作方案,授予美国Summit Therapeutics公司在美国、欧洲、加拿大和日本的开发独家许可权,创下中国单个创新药物对外权益许可最高交易金额纪录。此前,ivonescimab在肺癌领域的3项适应症已分别获得CDE授予的突破性治疗药物认定。2023年8月,ivonescimab首个新药上市许可申请(NDA)获得受理,并获优先审评资格。
三
恒瑞医药深耕医药行业五十余载,近年来研发投入不断增加;公司潜心打造技术平台,跻身国际一流水平,现有平台种类丰富,涵盖双抗、ADC等大分子药物,以及PRORAC新型小分子药物、基因治疗药物,AI分子设计平台。目前已确定有78项研究入选本次会议,包括4项口头报告、29项壁报展示、45项线上发表。研究成果涵盖消化系统肿瘤、乳腺癌、肺癌、妇科肿瘤、泌尿肿瘤、黑色素瘤、头颈肿瘤、肉瘤、鼻咽癌和血液肿瘤等十余个肿瘤治疗领域,涉及的创新药包括8款已上市创新产品,以及多款未上市创新产品。
本次披露的双抗药物SHR-1701是一款靶向PD-L1/转化生长因子-βII型受体(TGF-βRII)双抗,2020年11月,公司与韩国DONG-A ST公司(以下简称“东亚公司”)达成协议,以1.3927亿美元交易总额将SHR-1701项目许可给韩国东亚公司,同时获得韩国东亚公司的销售分成。韩国东亚公司将获得SHR-1701在韩国的独家临床开发、生产和市场销售的权利,被许可进行研发和销售SHR-1701用于所有人类疾病。
根据在2023 ESMO ASIA公布的数据,在3个NSCLC临床扩展队列中,SHR-1701均显示出令人鼓舞的抗肿瘤活性。根据研究者评估,3个队列的ORR分别为36.8%、19.5%和9.1%,疾病控制率(DCR)分别为66.7%、46.3%、54.5%,临床获益率(CBR)分别为40.4%、22.0%和15.2%。截至数据更新时,3个队列的中位缓解持续时间(DoR)分别为19.4个月、5.2个月和未达到。在晚期或转移性NSCLC患者中,SHR-1701同样显示出令人鼓舞的生存获益。截至数据更新时,队列1、队列2和队列3中患者中位PFS分别为5.3个月、1.4个月和2.1个月。中位OS分别为24.2个月、14.4个月和16.1个月。
四
泽璟制药是一家专注于肿瘤、出血及血液疾病、免疫炎症性疾病和肝胆疾病等多个治疗领域的创新驱动型化学及生物新药研发和生产企业,在本次ASCO中将披露自主研发的新药包括ZG005、ZGGS18、ZG0895、ZGGS15及多纳非尼、杰克替尼在内的合计19项临床研究结果。
1、ZG005
ZG005是公司自主研发的一种重组人源化抗 PD-1/TIGIT 双特异性抗体,拥有双靶向阻断PD-1和TIGIT的作用,既可以通过有效阻断PD-1与其配体PD-L1的信号通路,进而促进T细胞的活化和增殖;又可以有效阻断TIGIT与其配体PVR等的信号通路,促使PVR结合CD226产生共刺激激活信号,进而促进T细胞和NK细胞的活化和增殖,并产生两个靶点被同时阻断后的协同增强免疫系统杀伤肿瘤细胞的能力。
ZG005是全球率先进入临床研究的同靶点药物之一,用于治疗实体瘤患者的临床试验已获NMPA和FDA批准,其在中国的I期剂量爬坡已经完成,I/II临床试验正在开展中。公司正在积极推进ZG005单药治疗复发难治肿瘤、联合化疗和/或其它靶向治疗药物治疗多种实体瘤的临床适应症的探索研究。
2、ZGGS18
ZGGS18是一种重组人源化抗VEGF/TGF-β的双功能抗体融合蛋白,可以特异性地结合血管内皮生长因子(VEGF)和“捕获”转化生长因子-β(TGF-β),起到抑制肿瘤新生血管形成和降低肿瘤转移发生等协同抑制肿瘤生长的多重作用。另外,ZGGS18也可以改善和调节肿瘤微环境,从而可以和抗PD-1/L1抗体、公司正在开展临床研究的抗PD-1/TIGIT双特异性抗体ZG005等肿瘤免疫治疗药物联合增强肿瘤杀伤作用。
目前,ZGGS18用于治疗实体瘤患者的临床试验已获 NMPA 和FDA 批准,其在中国的I 期剂量爬坡已经完成,I/II 期临床试验正在开展中。
3、ZGGS15
ZGGS15是一个人源化抗淋巴细胞激活基因-3(LAG-3)和抗具有Ig和ITIM结构域的T细胞免疫受体(TIGIT)的双特异性抗体,有望用于治疗多种晚期实体瘤。ZGGS15拥有双靶向阻断LAG-3和TIGIT的作用,既可以通过有效阻断LAG-3与其配体MHC-II等的信号通路,激活TCR信号通路,又可以有效阻断TIGIT与其配体PVR等的信号通路,促使PVR结合CD226产生共刺激激活信号,进而促进T细胞和NK细胞的活化和增殖,并产生细胞因子,从而具有协同增强免疫系统杀伤肿瘤细胞的能力。
目前,ZGGS15用于治疗晚期实体瘤的临床试验申请已获NMPA和FDA批准,其在中国的I期剂量爬坡已经完成,I/II期临床试验正在开展中。
五
贝达药业成立于2003 年,是一家由海归高层次人才团队创办的、以自主知识产权创新药物研究和开发为核心,集研发、生产、市场销售于一体的高新制药企业。自2014 年公司Xcovery开展恩沙替尼的国内权益授权后,先后引进了天广实的贝伐珠单抗生物类似药卡南吉和Tyrogenex 的伏罗尼布、益方生物的甲磺酸贝福替尼,Merus 的EGFR/c-Met 双抗以及Agenus 的PD-L1&CTLA4 抗体组合疗法等。目前,公司已获批上市的药品有5 款,分别为:首款创新药盐酸埃克替尼(凯美纳)、盐酸恩沙替尼(贝美纳)、贝伐珠单抗生物类似药(贝安汀)、甲磺酸贝福替尼(赛美纳)和伏罗尼布(伏美纳)。
MCLA-129是由贝达药业与荷兰Merus共同开发的一种针对EGFR和c-MET的抗体依赖性细胞毒性(ADCC)增强型全长人IgG1 Biclonics®抗体;该药物抑制EGFR和c-MET的配体依赖性磷酸化和对多种EGFR和 c-MET表达水平异常和EGFR突变基因型NSCLC 细胞系显示ADCC和抗体依赖性细胞吞噬作用(ADCP) 。在多种不同的体内NSCLC模型包括EGFR外显子20ins患者来源的NSCLC异种移植模型导致剂量依赖性肿瘤抑制。
目前,MCLA-129正在人体开展临床1/2期试验MCLA-129-CL01,以评估MCLA-129的安全性,药代动力学、药效学、抗肿瘤活性和MCLA-129临床2期初始推荐剂量(RP2D)。初步研究结果显示:MCLA-129耐受性良好,安全性可控,在1000和1500mg q2w下实现了对可溶性EGFR和可溶性c-MET的最大抑制,在1500 mg q2w下,预计在整个给药周期中肿瘤靶点参与率为 >95%,在经过大量预处理的患者中观察到多种肿瘤类型和剂量水平的抗肿瘤活性,包括2例确诊PR和4名靶病变大小减少> 20%患者,初始 RP2D为1500mg静脉注射 q2w,扩展队列正在注册。
六
中国生物制药是正大集团旗下公司之一,其核心下属公司正大天晴、北京泰德等在肿瘤、肝病、外科/镇痛、呼吸系统治疗领域处于优势地位,是国内少数几家在肝病、肿瘤等领域商业化能力突出的大型药企。本次ASCO中,正大天晴将公布51项最新临床研究和基础研究数据,包括1类创新药安罗替尼(小分子多靶点受体酪氨酸激酶抑制剂)、艾贝格司亭α(第三代双分子G-CSF)、派安普利单抗(PD-1抑制剂)及在研创新项目贝莫苏拜单抗(TQB2450,PD-L1抑制剂)、TQB3617、TQB3728、TQB2930等创新肿瘤药物。
1、TQB2930
TQB2930是一种靶向HER2的双特异抗体,实现了针对两个靶点的协同增效作用。其能够阻断肿瘤生长的驱动基因信号,并通过多种机制杀伤肿瘤细胞。临床前药效试验显示,该分子能够显著抑制肿瘤生长,其效用优于曲妥珠单抗和帕妥珠单抗联用。
2、FS222
FS222是CD137/PD-L1 靶点的双特异性抗体,通过阻断PD-L1免疫检查点来靶向关键的肿瘤免疫抑制通路,并通过CD137的强效聚集和激活,进而协同促进T细胞的活化,增强细胞毒性T细胞的应答。2023年,中国生物制药成功收购英国生物科技公司F-star,引入了全球领先的双抗技术平台;FS222是F-star自有在研项目之一,现处于临床开发阶段。在临床前模型中,相较于CD137单抗与PD-L1单抗联用,FS222可以同时靶向CD137与PD-L1,促进T细胞的增殖及细胞因子的生成,进而清除肿瘤细胞。
七
友芝友
M701为注射用重组抗EpCAM和CD3双特异性抗体,EpCAM为肿瘤细胞靶点,CD3为免疫细胞靶点,M701进入体内后,可同时结合免疫细胞和肿瘤细胞,CD3抗体可以桥接T细胞并激活T细胞杀伤EpCAM阳性肿瘤细胞。2024年3月,CDE官网显示,M701已经开始Ⅲ期的临床研究,正在招募晚期上皮性恶性实体瘤(包括卵巢癌、胃癌、结直肠癌)伴恶性腹水患者入组。
在2021 ASCO中,友芝友生物报告了M701在标准治疗失败的恶性腹水患者中的I期试验的中期结果。截至2021年2月,共有23例患者入选(12名卵巢癌,5名胃癌,6名其他癌症),在16例可评估的患者中,腹水的ORR为62.5%(10/16),疾病控制率(DCR)为100%(16/16),其中3例CR(完全缓解),7例PR(部分缓解),6例SD(病变稳定)。中位总生存期(OS)为152天,其中,卵巢癌患者的中位OS为148天,胃癌患者的中位OS为209天。在PR和CR患者中,EPCAM+/CD45+细胞比率持续下降,这表明T细胞持续募集和肿瘤细胞消除。