


正文共:3234字 3图
预计阅读时间:10分钟
昨晚召开的FDA专家咨询委员会,还挺有戏剧性的。
虽然专家咨询委员会以9:3的投票结果支持Alnylam的RNAi药物"patisiran(商品名Onpattro)治疗转甲状腺素蛋白介导的淀粉样变性心肌病(后文称ATTR心肌病)的益处大于其风险",但还是一致认为,patisiran的用药获益很小,只不过风险更小……
唉,看来patisiran的这场“BOSS战”,看起来打赢了,但恐怕最后还是要输……
01 “少白头”的FIC
Patisiran是Alnylam的核心产品之一,既是“全球首款RNAi药物”也是“全球首款siRNA药物”,帮助Alnylam确立了RNAi领域的TOP1地位,是这家biotech商业化之路的开路先锋。在patisiran上市后,Alnylam在短短5年内又上市了4款药物,以二百余亿美元市值之姿,跻身全球药企TOP50。
但patisiran这款药物似乎有了一些“未老先衰”的迹象。尽管这款上市了5年的药物在2022年仍处于放量阶段,年销售额增长17.5%,达5.58亿美元。但商业上总给人一种要“到此为止”的感觉。
很大程度上是由于同是Alnylam开发的新一代同适应症RNAi药物vutrisiran在2022年获批上市,开始挤占“自家前辈”的市场份额导致的。Vutrisiran在2023年第二季度的净收入为1.32亿美元,而patisiran的净收入则为9100万美元。
考虑到Alnylam目前仍处于亏损状态,任何一条上市管线出现这种情况应该都是不能接受的,为patisiran寻找新的出路势在必行。好在patisiran的靶点不错,可以考虑拓宽patisiran的适应症标签,这么做既可以延长patisiran的商业生命,防止两代药物之间相互竞争冲突,也能为Alnylam拓宽管线领域。
02 临床试验,FDA不太买账
Patisiran靶向的转甲状腺素蛋白负责在血浆和脑脊液中转运甲状腺素和与视黄醇结合的视黄醇蛋白,但某些罕见的基因变异会导致转甲状腺素蛋白发生病变,出现淀粉样变性,并在包括周围神经、心肌间质在内的多种器官中积累,持续造成严重的器官受累。一般从确诊“转甲状腺素蛋白淀粉样变性引起的病变”开始,患者基本仅剩下五年不到的寿命。
Patisiran在2018年获批的适应症是“成人遗传性ATTR淀粉样变性的多发性神经病变(后文简称ATTR神经病变)”,而此次想要获批的是ATTR心肌病。
今年Alnylam公布了patisiran治疗ATTR心肌病的APOLLO-B 3期临床试验的结果,证明该药物在ATTR心肌病方面具有有统计学意义的疗效。
但FDA似乎对于试验结果并不买账。FDA表示:“与安慰剂相比,patisiran对两个试验终点的影响都很小,临床意义值得怀疑,患者可能无法感知到。”
FDA这里提及的两项试验终点指的是pastiran的3期临床试验APOLLO-B的主要终点——6分钟步行试验(6MWT)的基线变化和次要终点——第12个月时堪萨斯城心肌病问卷-总体总结评分(KCCQ-OSS)的基线变化。
尽管两项临床试验均得出了具有统计学意义的有效结论,FDA也对此表示认可,但FDA依旧认为这两项试验终点并不能展示patisiran对ATTR心肌病具有明显的治疗效果。
6WMT试验就是让已经出现心力衰竭症状的患者在平坦路面行走6分钟,记录患者在6分钟内步行的距离(6WMD)。
接受了patisiran治疗的受试者在12个月时6MWD从基线时的平均361米减少了13米,而安慰剂组的受试者在12个月时减少了31米。
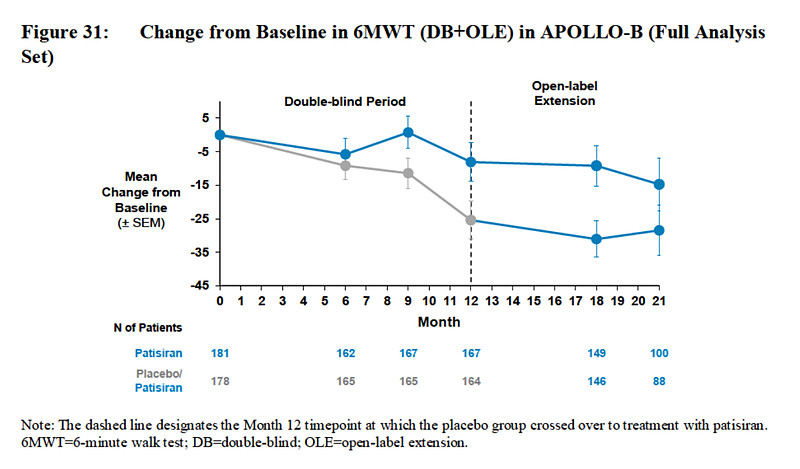
图片来源:专家咨询委员会附件
堪萨斯城心肌病问卷(KCCQ)是临床上衡量心力衰竭对生活影响的常用办法,通过23个问题衡量患者对于其自身健康状况的感知。
平均而言,接受patisiran治疗的受试者在12个月时的KCCQ-OSS比平均基线得分69.8分增加了0.3分,而安慰剂组的受试者在12个月时的KCCQ-OSS比平均基线得分70.3分减少了3.4分。
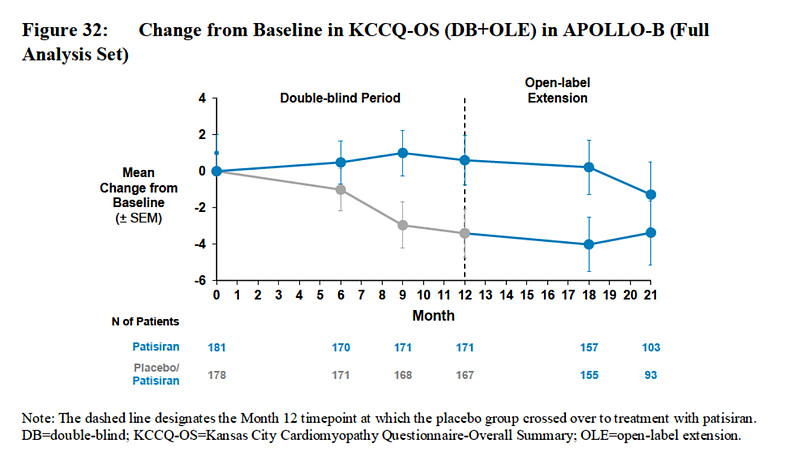
图片来源:专家咨询委员会附件
03 手下败将,亦是英雄好汉
FDA有这个顾虑,是因为ATTR心肌病已经有了一款比较成熟的治疗药物——辉瑞的tafamidis。
Tafamidis也是一款靶向转甲状腺素蛋白的药物,但技术路线与patisiran完全不同。Tafamidis旨在增强ATTR的稳定性,让其不那么容易病变;而patisiran干脆阻止了ATTR的生成。
Tafamidis最早想要挑战ATTR多发性神经性病变的适应症,但却因临床证据不足,在2012年遭到了FDA的拒绝,FDA要求辉瑞完成第二次药效研究,以建立更充足的疗效证据。
可能是预估到了patisiran将会成为tafamidis在该领域的强力竞争对手,辉瑞决定避其锋芒,立刻转向ATTR心肌病适应症的开发,并在2019年成功获批上市。
2023年,tafamidis的全球销售额已经达到了24亿美元,是Alnylam所有上市产品销售额总和的3倍左右。
如果不考虑时间问题,tafamidis确实在ATTR多发性神经病变领域败给过patisiran一程,但未曾想现如今patisiran很可能需要战胜它才能完成扩大适应症标签的征途。
FDA认为,必须要考虑到患者是否有接受过tafamidis治疗的背景,并且要衡量patisiran单药治疗的临床获益。简单来说,就是如果tafamidis的治疗效果更好,患者反而使用了patisiran,会不会耽误治疗?
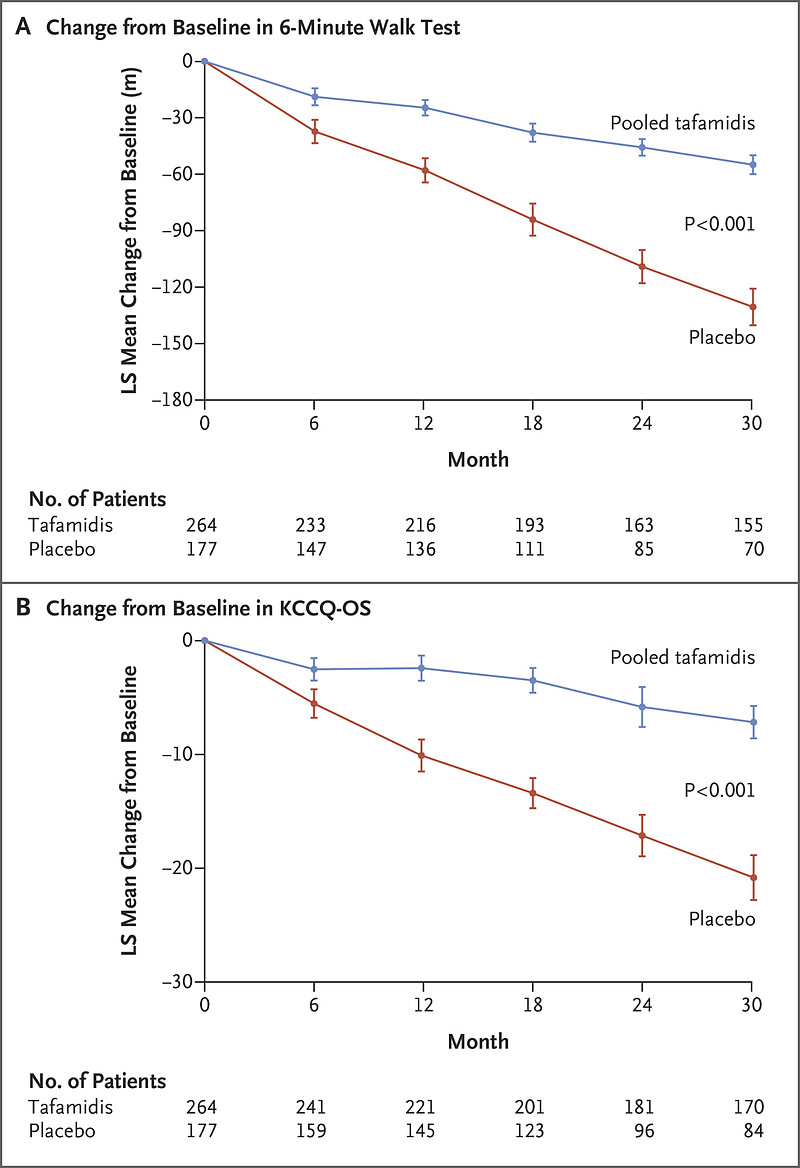
本图为tafamids的3期临床试验结果,6MWD与KCCQ-OSS为该试验的两项次要终点。
图片来源:Tafamidis Treatment for Patients with Transthyretin Amyloid Cardiomyopathy
这也很好理解,一旦患者确诊了ATTR心肌病,生命就已经进入了最后的倒计时。哪怕说patisiran只是疗效一般,都可能会耽误患者的治疗历程。
而偏偏patisiran就是那款疗效相当一般的药物。
04 虽然赞成,但质疑仍存
这种对patisiran的怀疑始终未从FDA与与会专家身上消散。
不消说投了3票反对票的专家,就连9票赞同票中,也有多位专家认为自己的结论比较摇摆。
约翰·霍普金斯大学医学院的Edward Kasper 打了个比方,他之所以投“赞成”票,是因为“微风”带来获益,“无风”带来风险。
西北大学范伯格医学院教授David Cella虽然投了赞成票,但仍指出patisiran的获益有限。不过他依然希望临床医生能够就这一选择向患者提供建议。
小肯塔基大学医学中心内科教授David Moliterno,用棒球来比喻他为什么要投“赞成”票。他说他的赞成票是“触击安打”(棒球赛中的一种进攻战术,通过一次小幅且稳定的进攻创造更好的得分机会),而且在非白人群体中,patisiran的疗效更加不明显了。
也就是说,哪怕是投了赞同票的专家,也认为patisiran很可能只是一种权宜之计。
那么patisiran和tafamidis可以联用吗?专家咨询委员会也觉得不行,一致认为tafamidis 与 patisiran 的相互作用“令人担忧”。
05 前途未卜,难以评说
patisiran以9:3的票数通过了专家咨询委员会决议,但毕竟专家咨询委员会只需要考虑临床获益问题,不需要考虑patisiran扩大适应症标签后的商业问题。
即便patisiran成功获批ATTR心肌病适应症,恐怕商业上也已经提前判了它死刑。毕竟可能不太会有医生给行将就木的患者在有更佳选择的情况下,下patisiran处方的机会。patisiran很有可能变成了一个罕见病的二线治疗方案(也是最终的治疗方案)。
更何况Alnylam的销售团队与辉瑞的销售团队在规模与实力上都不知道差了多少个级别,光凭这次专家咨询委员会给出的结论,都够辉瑞在线下推广时压得Alnylam喘不过气来。
哪怕说FDA最后没有听从专家咨询委员会的投票结果,拒批了patisiran,也在意料之内情理之中。
对于现在的困窘局面,Alnylam有太多问题和假设需要考量:
无论获批与否,专家咨询委员会的结论会不会对Alnylam的“扭亏转盈”计划造成影响?如果不能瓜分tafamidis24亿美元的市场份额,又该去哪里给自己找补?
如果真的出现拒批情况,那么patisiran是否还要继续单药的治疗方案,或者尝试与tafamidis握手言和,进行联用的临床试验呢?Alnylam还要继续“头铁”,重做临床试验吗?
为什么辉瑞当年败给Alnylam都能忍下来卧薪尝胆,现如今Alnylam还要去做已经被辉瑞抢占市场的适应症?
06 结语
今年7月,Alnylam曾与罗氏联合宣布,双方达成合作协议,共同开发和商业化其颇具潜力的在研新药 zilebesiran。Alnylam将在美国市场与罗氏共同商业化,利润平分;在美国市场之外,罗氏拥有独家商业化权益,Alnylam获得最低两位数的销售分成。
这种行为遭到了投资者的反对,合作协议达成后,Alnylam股价连续多日下跌,市场明显利空。
图片来源:雪球
市场考虑的是zilebesiran的临床1期数据优秀,Alnylam资金也尚且充裕,完全有能力独立开发,如今与罗氏开展合作,反而痛失了潜在“重磅炸弹”的独占权;同时zilebesiran研究进度被再度拉长,也有可能错失先机。
当然,市场风云莫测,药物研发也常会出现诡谲多变的怪事,zilebesiran在后续研发中功亏一篑,Alnylam通过本次合作减少损失的可能也确实存在。但以Alnylam的研发实力作为担保,这样的合作协议在外人眼里看来是过于保守的。
Alnylam应该属于千禧年之后诞生的biotech中,发展最快的一支。创立20年就能做出5款上市产品,冲进全球药企TOP50,并成为一整个RNAi药物研发类别的TOP1,其背后强大的研发团队功不可没。
但有强大的研发团队并不代表就能在市场上立足,Alnylam的问题实际上是许多biotech的共同问题:“光有一身腱子肉,却不知道力往哪里使”,商业合作以及很大程度上由商业化引导的药物后续开发总让投资者有些摸不到头脑。
肯定是“吃一堑长一智”,但是biotech们到底能吃多少“堑”?这个数字可能对于Alnylam是10是20甚至是100,但对于更多的中小型biotech,摔倒了,就是跌进万丈深渊。
参考资料
FDA Questions Efficacy of Alnylam’s Drug in ATTR-CM Ahead of Adcomm Meeting | BioSpace
September 13, 2023 Cardiovascular and Renal Drugs Advisory Committee Meeting (fda.gov)
UPDATED PUBLIC PARTICIPATION INFORMATION: September 13, 2023: Cardiovascular and Renal Drugs Advisory Committee Meeting Announcement - 09/13/2023 | FDA
September 13, 2023 Cardiovascular and Renal Drugs Advisory Committee Meeting (fda.gov)
封面图来源:pixabay-NoName_13
