2024年4月26日
医麦客新闻 eMedClub News
脑转移(BM)是晚期非小细胞肺癌(NSCLC)患者癌症相关死亡的主要原因之一。然而,由于血脑屏障(BBB)的存在,可用的治疗方法有限。外泌体已被证明是一种具有低免疫原性和高相容性的天然载体,使其成为运输癌症治疗试剂的理想工具。J Nanobiotechnology于2024年4月8日发表了一篇文章:Anti-EGFR ScFv functionalized Exosomes delivering LPCAT1 specific siRNAs for inhibition of lung cancer brain metastases。在这项研究中设计了一种由scFv和外泌体表面蛋白 lamp2b 组成的融合蛋白,该融合蛋白在来源于HEK293细胞的外泌体表面表达,以实现细胞靶向和治疗功能;用LPCAT1 siRNA(siLPCAT1)包封携带EGFR的工程外泌体,工程化外泌体显示出高颅内通透性和对脑肿瘤的递送效率,在癌症转移性脑肿瘤中发挥了强大的抗肿瘤作用。


1
在基因表达综合库(GEO)中进行了搜索,并最终纳入了一个队列(GSE131907,Ahn M等人),其中包含来自44名患者的58个组织样本的scRNA-seq数据,包括11个正常肺组织、11个原发肿瘤组织、10个脑转移和其他组织。
2
6周龄的雄性BALB/C裸鼠(18-20g)建立了肺癌荷瘤小鼠模型。然后将其随机分为3组(PBS组, Exoctrl 组, ExoscFv 组, n = 3)以评估scFv修饰的外泌体的分布。为了评估抗肿瘤作用,将患有BM肿瘤的小鼠随机分为三组(n = 5)(PBS组, ExoscFv/siLPCAT1组, ExoscFv/siNC组)。

1
LPCAT1在肺癌脑转移的恶性细胞中高度上调
为了进一步了解LPCAT1在NSCLC原发性肿瘤和转移性病变中表达的异质性和意义,我们获得并分析了肺腺癌脑转移单细胞转录组测序数据集(GSE131907)。在数据处理和注释后,对均匀流形近似和投影(UMAP)图谱和27种细胞亚型进行分层。30272个上皮癌症细胞以0.8的分辨率分类为3个簇,原发性癌症细胞、转移性脑肿瘤细胞和转移性淋巴结癌症细胞可以通过UMAP图最佳分离,表明脑转移和原发性肿瘤之间的恶性细胞存在显著的异质性(图1A-B)。此外,发现LPCAT1的表达显著升高,特别是在BM样品中,这表明LPCAT1上调的恶性癌症细胞易于迁移到大脑(图1C-D)。
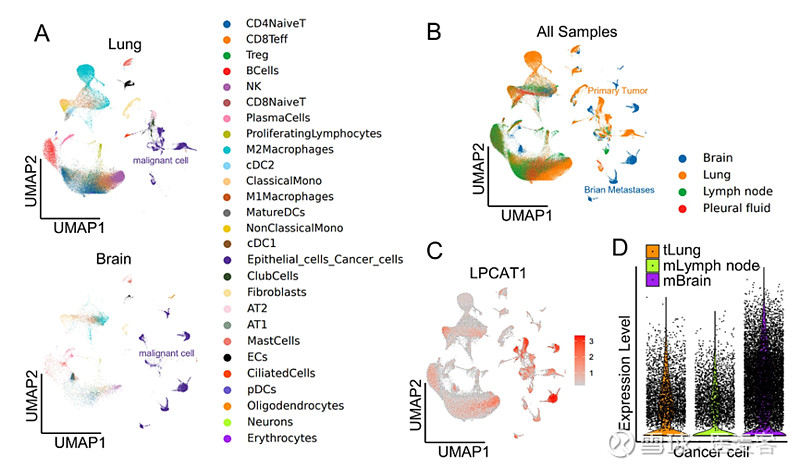
图1 通过scRNA-seq分析鉴定LPCAT1表达模式。(A)基于GSE131907数据集的主要细胞谱系和组织学类型(包括原发性肺肿瘤、脑转移组织)着色的细胞亚群的UMAP图。(B)基于组织类型(包括肺、脑转移、淋巴结组织和胸水细胞)着色的所有样本的UMAP图。(C-D)由UMAP图和Violin图表示的LPCAT1在肺肿瘤、脑转移、淋巴结组织中的平均表达。
2
ExoscFv的体内分布
为了评估ExoscFv的肿瘤靶向能力,我们首先建立了荷瘤小鼠模型,通过尾静脉注射200µg DiD标记的Exoctrl或ExoscFv(图2A)。使用IVIS在1小时、24小时、48小时和96小时监测外泌体的生物分布。如图2B所示,自注射后1小时起,可以产生足够的荧光,并逐渐扩散到全身,尤其是网状内皮系统,如肝、肺和脾。然而,对照组肿瘤块中的荧光强度在注射后48小时前开始减弱(图2C)。相反,ExoscFv组的肿瘤荧光强度在48小时达到峰值。
此外,ExoscFv组在96小时的残余荧光强度是Exoctrl组的两倍。值得注意的是,通过离体荧光成像验证,肿瘤中滞留了大量的外泌体(图2C)。此外,冷冻组织切片的荧光成像显示,DiD标记的外泌体主要在肺和肝中检测到,其次是肾、心脏和肿瘤,与体内成像结果一致(图2E)。此外,ExoscFv在肺、肾、肝和肿瘤中的半衰期分别为14.51小时、22.23小时、32.89小时和71.37小时。这些结果表明,EGFR-scFv修饰有效地增强了外泌体的肿瘤靶向性,并延长了外泌物在肿瘤中的滞留时间。

图2(A) 实验过程示意图。通过尾静脉将200µg ExoscFv、200µg Exoctrl或PBS注射到PC9荷瘤小鼠中,n = 3,外泌体剂量 = 10 mg/kg。(B)外泌体分布的全身图像。注射后在指定时间间隔获得的图像,n = 3。(C) 肿瘤部位荧光强度随时间的变化,n = 3.(D)注射后96小时DiD标记的外泌体在器官中分布的离体荧光成像。(E) 肿瘤冷冻切片的荧光图像通过共聚焦荧光成像(红:DiD,蓝:DAPI)
为了进一步评估ExoscFv的脑渗透性和骨髓损伤靶向能力,我们根据先前的方法开发了动物骨髓模型。将稳定表达荧光素酶的PC9细胞通过脑实质内植入注射到BALB/c裸鼠的纹状体中。通过生物发光成像监测肿瘤生长。一周后,体内成像显示BM模型成功建立,因为在植入部位观察到IVIS阳性灶。分别通过尾静脉给荷瘤小鼠注射DiD标记的Exoctrl或ExoscFv。使用IVIS在0.5小时、3小时、6小时和24小时监测外泌体的生物分布。

热议话题
肺球细胞来源的肺干细胞外泌体治疗特发性肺纤维化治疗进展
iPSC来源外泌体治疗缺血性脑卒中的早期临床探索
人源干细胞膜外囊泡鼻脑递送小核酸治疗阿尔兹海默病研究进展
ips来源外泌体药物开发
间充质干细胞外泌体的规模化制备与应用
工程化外泌体载药策略与临床应用挑战
工程化外泌体递送siRNA药物的开发进展
工程化外泌体递送蛋白在抗衰老领域的应用
自组装外泌体递送siRNA治疗亨廷顿舞蹈症的开发进展
外泌体在核酸类药物透脑靶向递送上的应用
echosome工程化改造平台助力外泌体药物开发
基于细胞外囊泡的程序化药物递送系统——TAXY
外泌体载体开发的技术挑战
外泌体工业化制备及外泌体偶联技术平台建设及应用
扫码
限时领取
免费门票

合作热线

18701871600(王经理)
15572286596(袁经理)
15221150919(和经理)
本研究采用24小时IVIS成像。如图3A-B所示,注射后3小时的成像显示ExoscFv在小鼠大脑的肿瘤部位快速积聚,因为荧光强度远大于Exoctrl组。值得注意的是,有大量的外泌体定位在大脑中(图5C-D)。此外,如图5E-F所示,与注射Exoctrl的小鼠相比,来自注射ExoscFv的小鼠大脑的PC9 BM切片表现出显著增加的DiD信号强度,并且在相邻的正常脑组织中没有观察到信号。重要的是,两组的荧光差异在BM模型中出现得更早,这可能是由于血脑屏障的存在,因为外泌体必须以较慢的速度进入肿瘤部位。

图3 PC9 BM模型中ExoscFv和Exoctrl的体内分布。(A) 外泌体分布的全身图像。注射后在指定时间间隔获得的图像,n = 3,外泌体剂量 = 10 mg/kg。(B)大脑部分荧光强度随时间的变化,n = 3.(C)注射后24小时主要器官的离体荧光图像。(D) BM模型的离体荧光图像。(E) 通过共聚焦荧光成像(红:DiD,蓝:DAPI)拍摄肿瘤冷冻切片的荧光图像。比例尺= 750μm(左)、150μm(中)、75μm(右)trl。(F) 图5E中荧光信号强度的量化****
3
ExoscFv/siLPCAT1具有体外抗肿瘤作用
为了验证LPCAT1是否可以成为NSCLC BM治疗的治疗靶点,在本研究中,首先制备了siLPCAT1负载的ExoscFv。随后,文章评估了负载LPCAT1 siRNA的外泌体(ExoscFv/siLPCAT1)在PC9细胞中的基因沉默效果。PC9细胞具有比Beas2b肺上皮细胞更高的EGFR表达。与对照相比,ExoscFv/siLPCAT1导致PC9中LPCAT1的表达显著降低(图4A-B)。接下来,通过CCK8和FCM检测,探讨了ExoscFv/siLPCAT1在癌症肺细胞增殖和凋亡中的作用。CCK8测定显示,与对照组相比,ExoscFv/siLPCAT1组的细胞增殖受到显著抑制(图4C)。类似地,FCM测定显示,在ExoscFv/siLPCAT1组中,PC9细胞的增殖活性显著降低(图4D-E)。FCM测定还显示,相较于ExoscFv/siNC处理的细胞(5.84 ± 0.88%),ExoscFv/siLPCAT1处理的PC9细胞具有显著更高的晚期凋亡率(13.03 ± 0.73%)(p

图4 ExoscFv/siLPCAT1的体外抗肿瘤作用。(A) 用ExoscFv/siLPCAT1或ExoscFv/siNC处理的PC9细胞中LPCAT1蛋白表达的蛋白质印迹分析。(B) 用ExoscFv/siLPCAT1或ExoscFv/siNC处理的PC9细胞中LPCAT1 mRNA表达的相对变化(数据表示为平均值 ± SD.n = 3.(C) 用PBS、ExoscFv、ExoscFv/siLPCAT1或ExoscFv/siNC处理的PC9细胞的CCK8测定,数据表示为平均值 ± SD.n = 3.(D-E)用PBS、ExoscFv、ExoscFv/siLPCAT1或ExoscFv/siNC处理的PC9细胞中ki67表达的流式细胞术测定
4
ExoscFv/siLPCAT1具有体内抗肿瘤作用
接下来,文章探讨了EGFR特异性scFv功能化的ExoscFv是否可以在体内有效地将siLPCAT1通过血脑屏障递送到癌症的BM部位。体内测定程序的示意图如图5A所示。注射后第二天记录小鼠的体重,并在同一时期通过IVIS监测肿瘤生长。如图5B所示,与PBS或ExoscFv/siNC处理的小鼠相比,ExoscFv/siLPCAT1处理组中的小鼠在第一周的体重减轻更少,并且从第19天到第21天,体重显著减轻。文章证明,与对照组相比,ExoscFv/siLPCAT1具有优越的抗肿瘤效果,因为IVIS中测得的脑转移的平均负荷光子通量显著较低。用PBS或ExoscFv/siNC处理的小鼠中的肿瘤快速生长并发出强发光。ExoscFv/siLPCAT1处理组显示出明显更小的生物发光面积和较弱的强度,定量显示,第19天,ExoscFv/siLPCAT1的肿瘤发光强度比ExoscFv/siNC组低约4.51倍(图5C)。为了证明siLPCAT1在体内的沉默功效,我们通过免疫荧光染色分析进一步检测了LPCAT1的BM位点表达。与PBS和ExoscFv/siNC组相比,来自ExoscFv/siLPCAT1组的肿瘤中LPCAT1的表达显著下调(图5D)。同时,为了阐明LPCAT1下调影响下BM的细胞增殖和凋亡变化,进行了TUNEL和Ki67染色。如图7D和图S7A所示,与用PBS或ExoscFv/siNC处理的小鼠相比,用ExoscFv/siLPCAT1处理的小鼠的肿瘤中TUNEL阳性细胞的数量显著增加。相应地,在来自ExoscFv/siLPCAT1组的肿瘤中也检测到Ki67阳性细胞数量的显著减少(图5D)。

图5 ExoscFv/siLPCAT1在体内的抗肿瘤作用。(A) 实验过程的示意图。(B) 用ExoscFv/siLPCAT1、ExoscFv/siNC或PBS处理的BALB/C裸鼠的体重变化, n = 5。外泌体剂量 = 5mg/kg。(C)注射后在指定的时间间隔用ExoscFv/siLPCAT1、ExoscFv/siNC或PBS处理的裸鼠的BM组织的代表性生物发光图像,n = 每5。(D) 共聚焦荧光成像检测BMs切片中LPCAT1(绿色)、ki67(绿色)和tunel(绿色)的信号。比例尺= 50微米

本研究展示了一种制备EGFR特异性scFv靶向外泌体的方法,该方法可增强外泌体的抗癌活性。scFv通过基因工程与lamp2b C端融合,是将治疗和诊断试剂输送到肿瘤部位的理想工具。外泌体的EPR效应和单链抗体的主动靶向特性使外泌体获得了良好的靶向特性。scFv修饰显著延长了外泌体在皮下肿瘤中的保留时间。此外,我们的ExoscFv成功地将LPCAT1 siRNA通过血脑屏障转运到靶向BM位点,并显示出强大的抗肿瘤功效,毒性可忽略不计。因此,基于外泌体的EGFR靶向siRNA递送系统是癌症BM的一种有前途的治疗策略,这将有望开发新的肺癌治疗方法。
声明:本文旨在于传递行业发展信息、探究生物医药前沿进展。文章内容仅代表作者观点,并不代表医麦客立场,亦不构成任何价值判断、投资建议或医疗指导,如有需求请咨询专业人士投资或前往正规医院就诊。

点点“分享”、“点赞”和“在看”,给我充点儿电吧~