医麦客近期热门报道
★ 治疗卒中,呈诺医学iPSC来源EPC细胞产品ALF201临床申请获国家药监局受理丨医麦猛爆料
★ 年初买买买!这家初创TIL公司为何值得被看好?丨医麦猛爆料
2021年1月24日/医麦客新闻 eMedClub News/--1月18日,解放军总医院韩为东教授团队在Nature Communications在杂志以“Low-dose decitabine priming endows CAR T cells with enhanced and persistent antitumour potential via epigenetic reprogramming”为题发表了一篇研究性论文。

该研究中,decitabine(地西他滨,5-aza-2’-deoxycytidine, DAC)处理的CAR-T细胞(dCAR-T),在体外和体内研究中的抗肿瘤活性,细胞因子产生和增殖均得到增强。此外,dCAR-T细胞可以在低剂量下根除体积庞大的肿瘤,并在肿瘤再攻击时建立有效的记忆反应。

近百位国内生物创新药的权威领袖发言,数百家领先的生物制药企业密切关注,逾千位医药领域的同行报名参加,数十种创新药技术集体亮相,聚焦肿瘤免疫、新型抗体、干细胞再生医学、基因治疗等四个热门生物医药领域,2021 BPIT 生物药创新技术大会即将于2021年3月25日-26日在上海拉开序幕!精彩纷呈(查看往年盛况)。点击“阅读原文”,立即报名!

dCAR-T:地西他滨(DAC)处理的CAR-T
针对CD19抗原的CAR-T细胞免疫疗法已在白血病和淋巴瘤患者中显示出临床疗效。目前全球已经有3款CAR-T疗法(Kymriah、Yescarta和Tecartus)获得批准上市,并且在多个国家和地区进行商业化使用,治疗淋巴瘤和血病患者。
但是迄今为止,这种疗法对淋巴瘤的疗效远不如其在急性淋巴细胞白血病(ALL)中有效,部分原因是CAR-T细胞进入了以抑制受体上调和效应子功能丧失为特征的耗竭状态。此外,ALL的复发通常也与CAR-T细胞持久性有限相关,这表明丧失了由CAR-T细胞介导的对白血病的主动监测。总的来说,T细胞常见的根除能力不足和功能障碍现象,是癌症免疫治疗失败的特征。
CAR-T细胞持久性的决定因素,除了固有的T细胞质量和初始T细胞表型,还没有完全阐明。临床前模型显示,长期存在的、具有更幼稚/干细胞/中央记忆样T细胞(Tscm/Tcm)表型的CAR-T细胞可实现对血液肿瘤和实体瘤的最佳控制。
许多参与免疫功能的基因都受到CpG甲基化的调控,表明这一过程在T细胞的功能和分化中发挥了作用。此前的研究也表明,de novo DNA甲基化显示可促进T细胞衰竭,限制抗PD-1免疫疗法,而抑制甲基化作用可增强PD-1阻断介导的T细胞再生;此外,在耗竭的T细胞中,伴随功能性DNA去甲基化的染色质可及性在转录起始位点区域降低。

▲decitabine分子结构(图片来源:维基百科)
去甲基化药物地西他滨是一种DNA甲基转移酶抑制剂,在美国已被批准用于治疗骨髓增生异常综合征和急性髓性白血病。研究表明,低剂量地西他滨能够提高肿瘤免疫原性,促进T细胞活化与增殖,增强机体抗肿瘤免疫应答。
因此,地西他滨可能提供了一种修改耗竭相关DNA甲基化程序的方法。
在这项研究中,研究人员使用低剂量地西他滨处理CAR-T,与CAR-T细胞相比,dCAR-T细胞中CD4:CD8 T细胞比率增加,并且中央记忆(Tcm,CD45RO + LCD62L +)和CD25阳性群体升高。在没有靶细胞刺激的情况下,dCAR-T细胞比CAR-T细胞分泌更高水平的T细胞增殖相关细胞因子IL-2和类似水平的肿瘤坏死因子α(TNF-α)和干扰素-γ(IFN-γ)。
地西他滨能抑制DNA甲基转移酶(DNMTs),研究中,体外低剂量、短期地西他滨治疗可持续诱导DNMT3a降解。具体来说,在地西他滨处理后,抗原表达触发了CAR-T细胞的DNA重编程效应,并且在体内和体外研究中,用地西他滨处理的CAR-T细胞在肿瘤细胞刺激下仍保持较高的记忆相关基因和相对较低的耗竭相关基因的表达。
为了进一步确定不同的表型和功能模式以及甲基化修饰模式,研究对处于“静止状态”(不受抗原或肿瘤细胞刺激)的dCAR-T和CAR-T细胞进行了全基因组转录谱分析和全DNA甲基化分析。与CAR-T细胞相比,dCAR-T细胞中全DNA甲基化组的平均β值降低,1034个基因启动子相关的CpG位点在dCAR-T细胞中被下调。
随后,在ALL和NHL小鼠模型中进行了体内研究,测试了dCAR-T细胞的功效。在“压力测试”中,与CAR-T细胞相比,dCAR-T细胞显示出强大的肿瘤控制能力。dCAR-T细胞的PD1/TIM3/LAG3表达明显低于CAR-T细胞,而正常CAR-T细胞表现出高耗竭表型,在ALL模型中扩增减少。在体外实验中观察到的细胞扩增在体内实验中也很明显,dCAR-T细胞的扩增能力远远优于CAR-T细胞,并且这种高扩增维持了1个月以上。
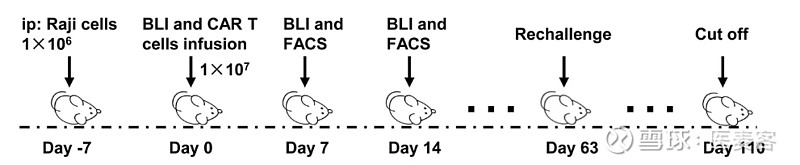
▲图片来源:参考出处1
重要的是,dCAR-T细胞可引发有效的记忆反应,实现T细胞再扩增并在肿瘤再攻击后完成肿瘤控制。相比之下,CAR-T细胞无法控制肿瘤再发,并且在体内无法再可检测到。

结语
CAR-T治疗变革了癌症的治疗方式,尤其在血液瘤中展现强劲临床前景。而进一步的改进和优化,将使这类策略的潜能进一步释放,以实现更好的临床获益。
参考资料:

医麦客始终致力于生物创新药的前沿技术、行业动态、产业洞察等原创新闻报道,全媒体高端矩阵用户达16万+,其中工业用户占比超50%,科研与临床用户约为30%,投资机构用户超过5%。为促进产业细分领域的互动交流,我们组建了多个专业微信群,欢迎扫码加群。
 点击“阅读原文”,立即报名!
点击“阅读原文”,立即报名!