//
Full Circles Therapeutics专注微型化、单链环形DNA非病毒基因定点整合技术,旨在通过基因书写与递送。公司已完成多项临床前验证,同时布局开展IIT,并已和欧美日及国内多家公司在早期技术平台验证上合作,获得100多万美元的营收。
在5月15日2024年DJS创新合作峰会上,Full Circles Therapeutics将现场路演。
撰文|毛冬蕾
基因治疗的技术精准性、安全性和高效性与日俱增。在这一背景下,全球一些领先的公司如Beam Therapeutics、Prime Medicine和Tessera Therapeutics等,正在积极推动基因治疗从传统的“基因编辑”向更为前沿的“基因书写”技术转变。
一家2021年设立在美国波士顿的新锐基因书写公司Full Circles Therapeutics(以下简称“Full Circles”)专注于微型化、单链环形DNA非病毒基因定点整合技术,旨在通过基因书写与递送,为人类疾病提供有效的治疗方案。
Full Circles副总裁陆渊在2024DJS代表公司路演,敬请关注。
单链DNA、非病毒基因、大片段书写
在与联合创始人之一的吴昊博士交流时,他首先介绍了基因编辑与基因书写之间的核心差异:
基因编辑主要依赖于CRISPR-Cas9等编辑工具,在生物体的基因组中实施定点修改,以调控或修复特定基因。而基因书写则对基因序列进行精准的设计、合成和修改,包括DNA或RNA序列的精确编写或重写。
“基因书写在克服基因编辑某些短板方面具有较大的潜在优势。”他说,“首先,基因书写能够实现对基因序列的精确合成和修改,减少非预期的副作用和基因损伤。其次,基因书写技术能合成全新的基因序列,以满足多样化的基础研究和临床应用需求。最后,基因书写技术能为个性化基因治疗和精准医疗的实现提供支持。”

吴昊
“单链DNA、非病毒基因定点整合是我们公司的首创和两大特色。”拥有上海复旦大学、香港科技大学、麻省理工大学(MIT)和约翰霍普金斯大学等名校履历的吴昊介绍了他们的特色。此外,他在美国还是多家知名大学校刊的科普专栏作家。
目前的基因编辑公司更常见的工具是双链线性DNA、单链线性DNA或双链环形DNA。吴昊说,双链DNA的致命缺点是双链DNA引起的免疫原性和细胞毒性,以及过低的基因书写效率。
而单链DNA相较于双链DNA,具有更低的免疫原性。这首先意味着单链DNA更不容易触发免疫系统的反应,提高了实验的稳定性和可靠性。其次,由于单链DNA的免疫原性较低,其在体内使用时引起的免疫反应较小,因此具有较高安全性。这在进行基因整合和基因敲除等实验时尤为重要,减少了对实验动物或人体临床研究的潜在风险。
Full Circles的研究人员已对三种核酸类别的分子——双链DNA、单链环形DNA及mRNA进行了广泛的实验和比较。研究结果显示,单链DNA的优势在于一旦高效的完成基因定点整合以后马上降解消失。这意味着它对免疫源性、免疫反应刺激,或对细胞毒性都大大降低。
“因此,在药物研发方面,利用单链DNA作为药物载体,成药性非常友好,也为其在药物研发中实现精准、高效的基因治疗。”吴昊说。
Full Circles的第二大特色是使用非病毒载体。吴昊说,大多数基因治疗公司仍使用病毒载体,病毒载体递送基因编辑的优势在于高效的基因传递和整合能力,实现稳定的基因表达。然而,基于病毒载体的基因编辑在生产成本、质控及免疫原性方面非常具有挑战性,且存在潜在的生物安全风险,需要严格的控制和监管。以美国FDA举例,针对病毒类基因细胞治疗需要跟踪随访15年之久。
非病毒大片段基因敲入方法的优势在于安全性高、无免疫原性,能减少生物安全风险。这种方法具有较广的细胞基因治疗适用范围。更重要的是,对于病毒载体系统而言,非病毒载体系统的生产工艺更简单、容易进行质量控制;同时在存储方面,非病毒载体使用的质粒DNA稳定性更高,存储的要求更低,有效期更长,无需冷链。比如在转染的这一环节上,非病毒载体的成本只有病毒载体的十分之一。
“非病毒类基因疗法的生产成本,预计是病毒类产品10%~20%的价格,这能让更多患者支付得起。”吴昊说。
因此,Full Circles通过四个首创的基因书写专利平台,实现非病毒载体的基因书写。在基因编辑片段的定点整合方面,完成基因编辑领域的“最后一里路”任务,从而可以广泛应用于遗传病、罕见病及众多与基因相关的疾病治疗。
同源重组的作用机理
在CRISPR领域,技术发展经历了从基因敲除到单碱基编辑,再到基因定点插入的演变过程。目前,全球已涌现出多家头部基因编辑公司,如CRISPR Therapeutics、Editas Medicine和Intellia Therapeutics等,这些公司在基因编辑技术的研发和应用方面取得了显著成果。
而Full Circles正站在这一技术前沿。公司采用微型化的单链环形DNA不仅串联起了2020年诺贝尔化学奖授予的CRISPR/Cas9技术基因编辑技术,还与2007年诺贝尔生理学/医学奖中授予的“基因打靶”技术DNA同源重组紧密相连。
说起同源重组技术,尽管该技术具有生物学和遗传学上有里程碑意义,但其实际操作效率极低,难以在临床应用中实现真正转化。以此技术为基石的代表性生物科技公司包括在Nasdaq上市、2022年底被AZ收购的LogicBio Therapeutics。

Full Circles之所以能使用单链环形DNA实现500多倍同源重组的效率提升,关键在于其独特的分子机制。这种机制主要基于同源重组原理,并充分利用内源性的多种蛋白酶,如RAD51整合酶。此外,结合外部双链DNA模板,单链环形DNA能够展现出诸多优势,从而实现500多倍打靶效率的提升。
首先,单链环形DNA的结构非常紧密,这种结构特点使得它在药物递送方面具有天然优势。利用体外成熟的电穿孔递送技术,高效地将单链环形DNA递送到细胞内。值得一提的是,电穿孔递送技术在T细胞、NK细胞等疗法中已经得到了广泛验证,证明其成熟性和可靠性。
其次,单链环形DNA作为一种闭环环状DNA,其分子结构异常稳定。这种稳定性类似于环形RNA,使得它能够抵御降解酶的攻击,确保在细胞内的稳定性和持久性。
第三,单链环形DNA的微型环结构是其第三个显著优势。在这个结构中,灰色部分的Fairing(见下图)作为外部“整流罩”保护着内部的基因编辑部分,绿色部分则是科研人员进行基因编辑的插入区域,而蓝色部分则是由两个同源臂(3'端和5'端)组成,它们能够与基因组上的特定位点形成同源互补,从而实现精准的定点插入。这种设计使得单链环形DNA能够像“找朋友”一样,精确地找到目标位置并进行插入。而且单链DNA的设计跨越了经典同源重组过程中的能量壁垒和限速步骤,即双螺旋DNA的解旋,使得同源重组的效率进一步得到质的飞跃。
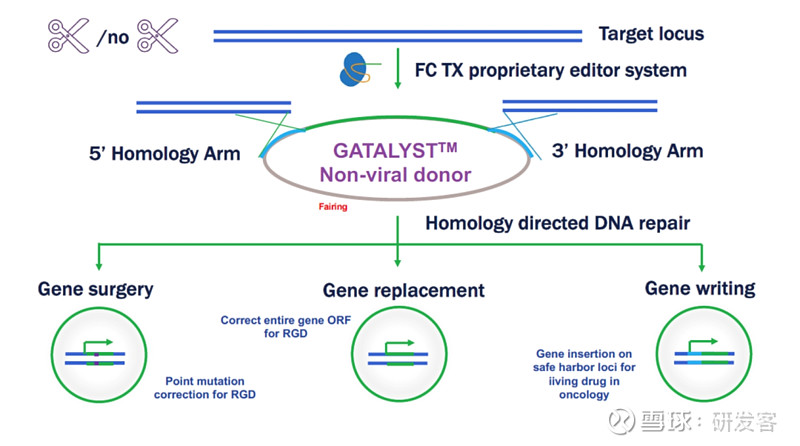
尤为重要的是,Full Circles另一位创始人单群博士早年的电镜和生物化学实验数据首次记录了重组酶和单链环状DNA,相比其他样态的DNA,比如线性单链DNA,具有更强的亲和力。为公司的平台技术奠定了早期的理论和实验基础。
研究人员利用CRISPR/Cas9系统实现定点定位打靶,该技术结合单链环状DNA同源重组与Cas9精准切割,确保基因编辑的准确性。“我们成功利用大片段基因定点敲入,取得显著成果,如2KB载荷敲入效率达70%,4.5KB载荷达35%,且仍有优化空间。定点整合打靶技术能精准控制基因突变位置,如C4DNA实现百分百精确度,是精准基因编辑的理想选择。”吴昊说。
此外,公司还有一个秘密武器——核酸酶。这种核酸酶是从古老的细菌中培养出来的,特别是在切尔诺贝利核电站附近核泄漏区域找到的。那里的环境极端恶劣,但这种细菌之所以能在核泄漏的环境中存活,原因在于它拥有一种强大的整合酶,以及卓越的DNA修复机制。
经过生物信息筛选和实验数据验证,Full Circles的研发人员成功地从这种细菌中提取出了一小段含有20个极具活力的氨基酸序列。它能被轻松地装载到任意核酸酶上。一旦装载完成,核酸酶能够吸附有效载荷,原本各自为战、互不相关的状态瞬间变成一个紧密相连的化合物。
这样的化合状态赋予了它非凡的能力。它能从细胞外精准地递送到细胞质,再深入到细胞核,形成一条充满活力的链条。这条链条高效地将核酸酶递送到细胞核的反应场所,进一步大幅提高了单链DNA同源重组的效率。这就是Full Circles拥有自主知识产权的核心秘密武器——核酸酶体系。它能够实现高效的定点整合,为研究工作提供了强大的支持。
最后,公司采用纳米脂质体(LNP)技术,专门针对肝脏进行靶向递送,开发更多针对代谢性疾病的治疗药物。Full Circles目前也在进一步开发肝外递送的新型LNP来实现C4DNA的体内递送。
GATALYST实现基因书写最后一公里
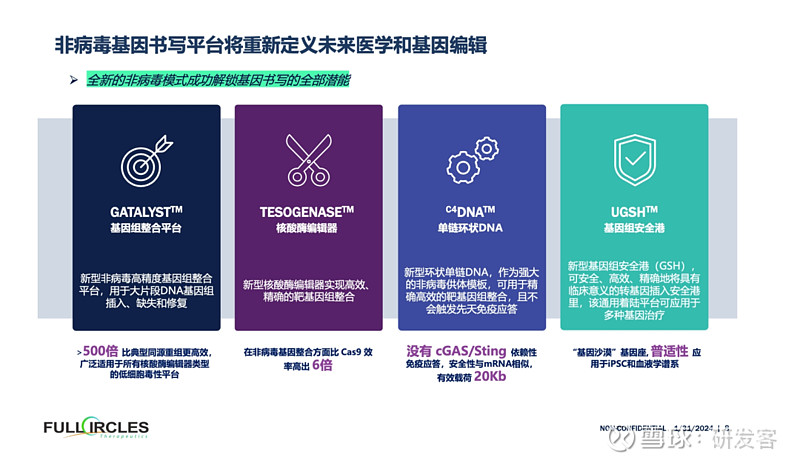
那么,如何实现大片段非病毒基因书写的最后一里路?目前,Full Circles拥有四个协同技术平台:GATALYST、C4DNA、TESOGENASE及UGSH。
其中,GATALYST平台以单链环状DNA为模板,实现高精确度、安全高效的大片段基因组整合,不触发免疫反应,载荷达病毒载量7倍,适用于各种核酸酶编辑器,且低细胞毒性。TESOGENASE核酸酶编辑器则实现高效精确的靶基因组整合,非病毒整合效率比CRISPR/Cas9高6倍。这些平台共同助力大片段非病毒基因书写的实现。
而UGSH基因组安全港,可以安全、高效、精确地将具有临床意义的转基因插入安全港里,该通用着陆平台可应用于多种基因治疗,降低药物研发成本。
值得一提的是,每一个平台都已在权威期刊上发表学术论文,均拥有专利支撑。综合而言,这4个平台技术共同构成了一个完善的工具箱,为大片段非病毒基因定点整合提供了强大的技术支持。
吴昊表示,Full Circles利用单链环形DNA的非病毒基因书写平台,旨在发现、开发和生产一次治疗、终身治愈的基因药物。总体来说,公司技术路径清晰明确,在体外,运用电穿孔技术;在体内,采用LNP技术,体内+体外的管线开发策略,二者确保高效大片段定点整合得以实现。这一技术能够用于基因修饰,以替换大片段的遗传疾病DNA,从而为患者带来更为精确有效,用得起和更安全的治疗方案。
基因书写未来趋势
公司创始人单群博士在从事学术研究期间,主攻基因重组的分子机理。他发现,单链环状DNA和基因书写能有机结合。他发现,单链环状DNA作为模板进行基因书写,比双链DNA效果要高30倍。

单群
单群对单链环状DNA的研究,萌芽于近三十年前他在威斯康辛大学做博士期间。当时他与其导师、分子生物学大师Michael Cox发现,单链环状DNA比单链线性DNA对重组酶RecA有更大的亲和能力。2019年底单群开始将项目向公司转化,因此成立了Full Circles的前身Stellate Biotherapeutics。
2021年4月,Full Circles 公司迎来吴昊的正式加入。吴昊天资聪颖,十分勤奋,他深耕基因/表观基因编辑、干细胞及新药研发20多年,是全球范围内第一波应用CRISPR技术进行基因编辑的科学家之一。曾在Whitehead研究院Rudolf Jaenisch实验室担任资深研究员,也曾任Fulcrum遗传病细胞生物学和研发负责人。除了科学事务,他还负责公司对外融资、合作。
2021年10月,Full Circles获得朗煜资本、维亚资本、AB Magnitude Capital的天使轮投资,公司已经建立一个小而精的团队,推进平台技术开发和临床转化。虽然成立不久,但公司已完成多项临床前验证,并于日前布局开展IIT,并已和欧美日及国内多家制药公司在早期技术平台验证上形成合作,并获得100多万美元的营收。
谈及未来,吴昊说,基因治疗是让人遐想无限的技术:一次治疗、终生治愈是无数患者和医疗工作者的梦想。“未来基因编辑的治疗领域充满了无限可能,我们努力成为全球顶尖的基因书写公司。一旦基因书写技术得以实现,无论是在遗传病、罕见病、肿瘤、自体免疫,还是其他与基因相关的领域,只要能确定基因变异的位置,就可以通过基因书写的方式,以大片段、超大片段的书写来解决问题,实现一次给药终身治愈。基因书写肯定今后10~20年的趋势。”
虽然因为资本寒冬,吴昊跟不下30多家投资人交流过,但他依然对行业的未来保持乐观,并对基因疗法的前景信心十足。
编辑 | 戴佳凌
dai.jialing@PharmaDJ.com
总第2092期
访问研发客网站可浏览更多文章