5月1日,CDE网站显示,贝达药业的泰贝西利胶囊(BPI-16350)上市申请获得受理,联合氟维司群,适用于既往接受内分泌治疗后进展的激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或晚期复发转移性乳腺癌患者。
泰贝西利是由贝达药业自主研发的全新的、拥有完全自主知识产权的新分子实体化合物,针对的靶点为细胞周期蛋白依赖性激酶4/6(CDK4/6)。今年4月,贝达药业宣布,已经完成了泰贝西利联合氟维司群对比安慰剂联合氟维司群治疗既往接受内分泌治疗后进展的HR+/HER2-的局部晚期、复发或转移性乳腺癌的III期研究,并取得临床试验总结报告。
研究结果显示,基于研究者评估,泰贝西利+氟维司群组用于既往接受内分泌 治疗后进展的HR+/HER2-的局部晚期或晚期复发转移性乳腺癌治疗的中位无进展生存期(PFS)显著优于安慰剂+氟维司群组。独立疗效委员会(IREC)和研究者评估的PFS结论一致。同时,泰贝西利+氟维司群组受试者安全性良好。
截至目前,国内共有四款治疗乳腺癌的CDK4/6抑制剂获批上市,分别是辉瑞的哌柏西利、诺华的瑞波西利、礼来的阿贝西利以及恒瑞医药的达尔西利。
Copyright 2024 PHARMCUBE. All Rights Reserved.
附:长江后浪推前浪,CDK4/6抑制剂赛道的风云变幻
产业资讯医药魔方2023.09.15
靶向疗法的出现使得癌症治疗的手段和理念发生了巨大变化,患者总生存期显著延长,癌症逐步慢病化。但更长时间、更高质量生存的未被满足需求始终指引着创新药研发者的前进方向,靶向疗法变革临床用药的探索仍在继续。
以K药为代表的PD-1疗法不仅横扫多种癌症类型,治疗场景也逐渐从晚期向早期肿瘤患者前移。HER2 ADC德曲妥珠单抗更是重新定义了人表皮生长因子受体2(HER2)表达乳腺癌分类和治疗方式。小分子靶向疗法也在不断开疆拓土。在激素受体阳性(HR+), 人表皮生长因子受体2阴性(HER2-)乳腺癌这一细分癌症人群中,CDK4/6抑制剂不断刷新着患者治疗方案和临床用药指南。近日,这一赛道又迎来了另一个重大利好消息。
近日,礼来的阿贝西利片扩展适应症获国家药监局批准,阿贝西利将适用于HR+, HER2-早期乳腺癌高危成人患者,即临床病理特征≥4枚阳性淋巴结,或1-3枚阳性淋巴结且同时具有至少以下一项:肿瘤大小≥5cm、组织学3级或Ki-67≥20%。相较于2021年12月获批适应症,此次批准不再限制阳性淋巴结≥4枚、肿瘤大小≥5cm或组织学3级患者的Ki-67检测水平,这意味着阿贝西利片联合内分泌治疗(ET)方案针对高危早期乳腺癌人群的进一步扩大。也意味着CDK4/6抑制剂在早期乳腺癌治疗中的又一个突破。
治疗场景前移,满足更广泛的临床需求
与所有抗肿瘤产品开发策略相同,CDK4/6抑制剂针对HR+, HER2-乳腺癌患者的临床开发也是起于晚期患者。在CDK4/6抑制剂未上市之前,晚期HR+, HER2-乳腺癌患者的一线、二线治疗方案均为单一内分泌治疗。不过临床上一直存在原发或继发耐药导致疗效降低的需求痛点,CDK4/6抑制剂的上市改变了这一窘迫局面。凭借在晚期患者中的显著获益,如今CDK4/6抑制剂联合内分泌治疗已经成为了晚期内分泌治疗敏感和内分泌治疗耐药HR+, HER2-乳腺癌患者治疗新标准。
在满足了HR+, HER2-晚期乳腺癌患者的用药需求之后,早期乳腺癌患者也成为几家布局CDK4/6抑制剂企业不约而同的适应症开发选择。背后的原因不难理解,一方面众多fast follow产品的出现使晚期患者的药物选择极大地丰富,患者生存期显著延长。相对而言,早期患者的治疗选择却比较匮乏。16年来,内分泌治疗一直是HR+早期乳腺癌的标准辅助治疗,相关学术研究都围绕在药物选择、治疗时长等方面开展[1]。
另一方面,相较于晚期患者,早期乳腺癌患者比例更高,存在巨大未满足需求。据统计,2020年中国每年乳腺癌新发病例41.6万人[2],大部分初诊为早期乳腺癌[2],随着人们对健康的愈加重视,以及医疗诊断水平的提高,癌症将会更早被诊断出来,未来这一数字还会继续增长。
对于高危早期HR+, HER2-乳腺癌患者,疾病复发、特别是远处转移性复发,仍然是一种常见的、危及生命的并发症。既往研究显示,经过单独内分泌治疗后仍有约30%的高危早期患者会复发[3],从而进展为无法治愈的转移性疾病,其5年复发风险是非高危患者3倍[4]。
不过CDK4/6再下一城。阿贝西利率先实现了HR+, HER2-高危早期乳腺癌辅助治疗领域16年来的首次突破。monarchE研究中位随访27个月结果显示,队列 1 Ki-67≥20%高危乳腺癌患者中,与标准ET相比,阿贝西利联合ET显著降低疾病复发风险37%(HR:0.63,95%CI:0.49-0.80,p=0.0002),3年无浸润性疾病生存(IDFS)率和无远处转移生存(DRFS)率绝对获益分别达7.1%和5.2%[5]。同时在Ki-67<20%的患者中观察到数值上的获益(IDFS HR=0.70,95% CI:0.51-0.98;nominal P=0.036)。
基于队列 1中Ki-67≥20%高危乳腺癌患者中的显著获益数据,阿贝西利获NMPA(2021年12月底)以及多国监管机构批准用于治疗淋巴结阳性,高复发风险且Ki-67≥20%的HR+, HER2-早期乳腺癌成人患者的辅助治疗,成为全球以及中国首款获批此适应症的CDK4/6抑制剂。
随着monarchE研究随访时间延长,阿贝西利联合ET组持续显示出临床获益。monarchE研究42个月随访数据显示[3,6],相较于单独使用标准辅助ET,阿贝西利联合ET可将HR+, HER2-高危早期乳腺癌患者的复发风险减少34%(HR:0.664,95%CI:0.578–0.762;P<0.0001)且无论Ki-67评分高低。阿贝西利联合ET组4年IDFS率和DRFS率都有显著获益,4年IDFS率和DRFS率整体绝对获益分别达6.4%和5.9%,总生存期(OS)也有获益趋势;中国人群复发风险降低了43.7%,4年IDFS率和DRFS率分别达8.9%和7.6%[7]。

monarchE研究中国人群数据 (来源:参考资料[7])
因此,阿贝西利近日再次获NMPA批准扩大适用人群,纳入了非Ki-67≥20%的患者。
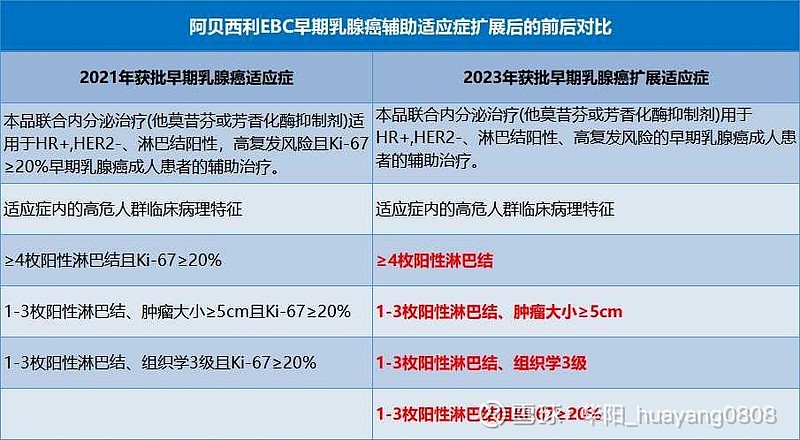
来源:药品说明书、医药魔方
针对HR+, HER2-早期乳腺癌,4款上市的CDK4/6抑制剂均开展了临床研究。除了monarchE研究研究外,诺华也于今年年中公布了瑞波西利联合ET辅助治疗II期和III期HR+, HER2-早期乳腺癌患者NATALEE研究积极中期IDFS结果,癌症复发风险降低了25.2%(HR=0.748;95% CI:0.618,0.906;p=0.0014),不过该研究结果全文尚未发表,瑞波西利也尚未在全球获批用于HR+, HER2-早期乳腺癌患者;哌柏西利辅助治疗的PALLAS和PENELOPE-B研究结果最终都为阴性。

来源:医药魔方DeepMed循证数据库
晚期癌症患者生存期短,试验成本低,也最先获得成果。相较而言,针对早期患者的临床开发耗时更长,受影响因素更多。当低垂果实摘完后对产品有足够信心的企业才会触及高垂果实。因此,在早期患者中获得积极结果也更能说明产品竞争力。阿贝西利是目前唯一同时拥有早期和晚期适应症的CDK4/6抑制剂。
更早纳入医保,渗透更广泛的患者群体
经过数年的医保政策改革,如今每年一次的目录调整成为了创新药唯一进入医保的机会。在医保基金作为最大支付方的中国市场,患者临床需求的满足主要依赖医保的支撑。越早纳入医保,意味着能够越早进行广泛患者人群的渗透,让更多患者更早实现新药可及,减轻用药负担。
目前,国内共有哌柏西利(辉瑞)、阿贝西利(礼来)、瑞波西利(诺华)、达尔西利(恒瑞)4款CDK4/6抑制剂获批治疗HR+, HER2-乳腺癌。从纳入医保的时间来看,虽然阿贝西利在国内的上市时间更晚,但是纳入医保目录的时间却比哌柏西利早了一年,该产品也是首款纳入国家医保目录的CDK4/6抑制剂。
从纳入医保的适应症数量来看,哌柏西利仅覆盖HR+, HER2-内分泌治疗敏感的晚期乳腺癌患者,达尔西利仅覆盖内分泌治疗耐药患者,阿贝西利是唯一同时覆盖内分泌治疗敏感和耐药患者的CDK4/6抑制剂。
2023医保目录调整在即,阿贝西利辅助治疗高危早期乳腺癌适应症、达尔西利和瑞波西利针对晚期内分泌治疗敏感患者适应症均已通过形式审查。如果纳入后,阿贝西利将成为首款医保同时覆盖早期和晚期HR+, HER2-乳腺癌患者的CDK4/6抑制剂,有望填补高危早期乳腺癌辅助治疗目录空白。实现治愈,回归社会和家庭是早期乳腺癌患者的治疗目标,CDK4/6抑制剂也将在助力患者在实现这一目标的路上,最大程度发挥其价值。
四款CDK4/6抑制剂进入国家医保目录情况

药品说明书、医保局官网
爱博新(哌柏西利)在国内上市时间最早,最开始凭借先发优势占领了国内市场较大份额,不过从2022年开始,其销售表现逐渐放缓,未来还将面对哌柏西利仿制药的冲击。目前中国CDK4/6抑制剂市场的领军位置已被阿贝西利强势反超并牢牢占据。这一方面得益于阿贝西利在更广泛早期乳腺癌患者中的使用优势,另一方面则是由于其最早被纳入医保目录,实现快速放量。阿贝西利核心专利中国到期时间为2029年12月15日,短期内不会面临仿制药影响,未来还将继续主导中国CDK4/6市场。

来源:医药魔方Pharma BI数据
放眼全球,通过对几款CDK4/6产品季度销售额的持续跟进,曲线图也出现了奇妙的变化,哌柏西利的销售额虽在过去6年遥遥领先于另两款产品,不过近两年却出现轻微下滑,基本无增长势头;瑞波西利也呈增长态势,不过增速较缓;而阿贝西利近两年的销售额增势迅猛,2023Q2的销售额与哌柏西利仅有一步之遥,预计在2023Q4很可能会与哌柏西利持平或超越哌柏西利。

注:1)此处仅统计获批乳腺癌CDK4/6靶向产品,故Cosela(曲拉西利)未放入图中;2)来源:公司财报、医药魔方
作为后来者,阿贝西利在HR+, HER2-乳腺癌开发过程中,从晚期适应症的跟跑到在早期适应症的领跑,已经走出了一条完美逆袭之路。
总结
多款CDK4/6抑制剂极大丰富了HR+, HER2-乳腺癌患者的治疗选择。阿贝西利虽不是first in class产品,不过在后续的开发中,凭借在高危早期患者中的显著获益使其市场表现出现弯道超车之势。这进一步验证了“产品为王”的理念,唯有使患者产生获益的产品能够赢得市场的认可。此外,除了产品本身之外,市场开发策略也是重要一环,阿贝西利能够在获批后的首个完整年顺利进入医保目录实现快速放量,也是一种值得后来者学习的产品开发策略。
参考资料
[1]. Sainsbury R. Cancer Treat Rev. 2013 Aug; 39(5); 507-17
[2]. 中国晚期乳腺癌规范诊疗指南(2022版);
[3]. StephenRD Johnston et al. Lancet Oncol. 2023 Jan; 24(1): 77-90.
[4]. Sheffield KM, et al. Future Oncol 2022; 18(21): 2667-2682.
[5]. Harbeck N, Rastogi P, Martin M, et al; monarchE Committee Members. Adjuvant abemaciclib combined