

我们一直强调,安全、有效、质量可控是保证药物成功上市的三要素。前面的文章中,只是简单提及一些相关的内容,接下来我们围绕这三个要素展开,重点讨论三要素的相关评价指标。希望大家读完以后能有一些基本概念,看到公司研发进展报告时能更深刻地理解报告中数据代表的意义。
我们先来看一下有关药效学的定义:
药效学,药物效应动力学简称药效学,是研究药物的生化、生理效应及机制以及剂量与效应之间的关系,其目的是确定新药预期用于临床防、诊、治目的疗效;确定新药的作用强度;阐明新药的作用部位和机制;发现预期用于临床以外的广泛药理作用。
药效学包括的内容有药物作用基本类型、药物作用的选择性、药物作用的量效关系、药物的治疗作用与不良反应、药物的作用机制。
从定义来看,关于药效我们需要重点把握的内容主要包括作用机制、作用强度、药物作用的量效关系、药物作用的选择性。下面,我们逐一进行阐述。
不过在开始之前,我们还应该想到要对这些性质进行评价,还需要借助可靠的实验模型。
通常,实验模型可分为体内模型和体外模型。实验结果要让人信服,那就必须要选用能反映药物作用的本质及与治疗指征相关的模型。比如要开发一个抗肿瘤药物,就应该选用相应的肿瘤模型,而不能选择糖尿病模型。
作用机制
作用机制研究就是明确药物进入体内后是如何发挥药效的。我们经常说,某某药物的靶点是什么或者说某某药物是某某抑制剂,其实就是在告诉大家药物的作用机制是什么。比如:
恒瑞卡瑞利珠单抗的靶点是 PD-1、吡咯替尼的靶点人表皮生长因子受体 2(HER2) ;豪森刚获批上市的阿美替尼是表皮生长因子受体(EGFR)酪氨酸激酶抑制剂;百济神州在美国获批上市的泽布替尼是 BTK (布鲁顿氏酪氨酸激酶)抑制剂。
知道了作用机制,我们可以通过文献调研来评估产品未来成功上市的可能性。在实际工作中,可以从以下几个方面进行简单评估:
该作用机制是否已得到充分研究:相关文献数量、发现时间等。该作用机制是否已有药物上市:可充分证明该作用机制可以用来开发药物。不过,这也带来另外一个担忧,就是对手已经上市,产品可能丧失了先发优势。这里注意只是说可能,因为产品优先上市固然重要,但若存在明显缺点的话,后来者依然有很大的优势。比如,亚盛医药的 Bcl-2 抑制剂 APG-2575,当前艾伯维的同靶点药物 ABT-199 在美国获批上市。这说明针对 Bcl-2 这个靶点开发药物是可行的。至于,亚盛医药的品种未来上市后,相对于 ABT-199 是否有优势,我们在后文借助其他信息来尝试对这一问题进行分析。
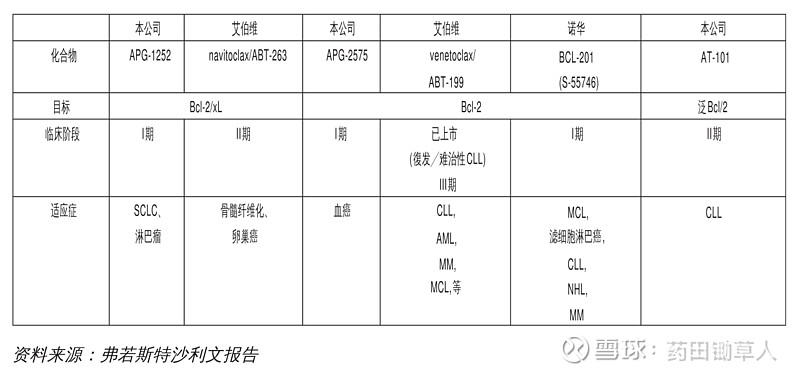
该作用机制还有哪些企业处于临床阶段:如果临床阶段药物较多,意味着未来上市后可能会面临较多的同机制品种的竞争。比如,开发 PD-1 单抗的企业就面临着这种局面。
现在借助于网络,针对某个靶点的全球管线信息可以很轻松地搜索获得,大家对此不必过于担心。
作用强度
作用强度其实也就是药物作用效果,常见的指标就是 IC50、 EC50 、抑瘤率、最小抑菌浓度(MIC)等等。鉴于肿瘤药最为常见,我们重点解释一下肿瘤药物评价中常用的指标。
IC50,又叫半数抑制浓度,也就是说达到这一浓度时,可以起到抑制或者杀死一半被测对象(酶、受体、细胞等)的效果。比如,针对某个酶,当体系中药物浓度达到 IC50 值时,有一半的酶活性会被药物抑制。通常,IC50 更常用于描述体外药效。EC50,又叫半数有效浓度,也就是说能达到 50% 最大生物效应对应的药物的浓度。EC50 既可用于表征体外数据,也可用于表征体内数据。抑瘤率,通常指在模型动物中,对肿瘤生长的抑制效率,其计算公式通常为(1-实验组肿瘤体积/对照组肿瘤体积)* 100%。有时候,也不一定会直接给出抑瘤率数据,而是像下图一样直接呈现各组的肿瘤体积变化情况。
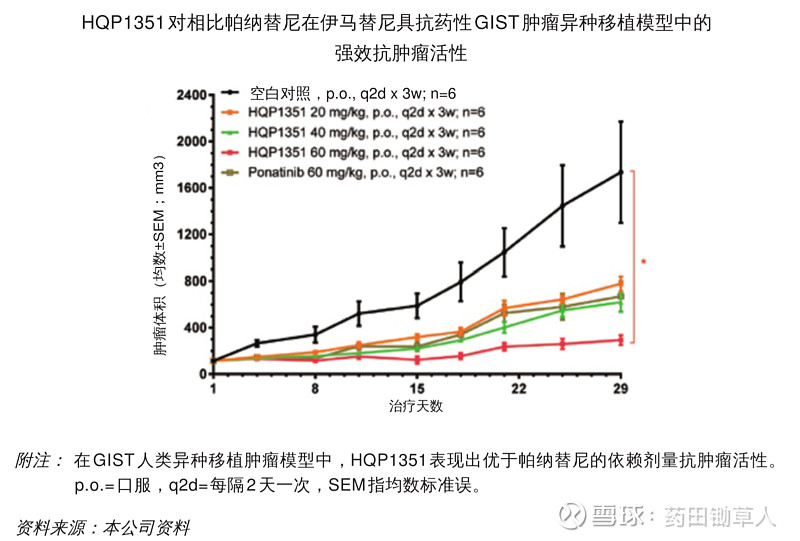
有了这些药效强度指标,我们可以大致地对目标药物的药效强度进行比较。需要注意的是,只有采用的实验模型相同时才可以进行简单对比。另外我们也要知道,由于生物试验误差不好控制,若不是直接在同一次实验中比较,而是利用文献报道的数据来比较,那么数据之间若不是数量级的差异,通常并不能作出充分的结论。
2019 年底,赛诺菲以大约 25 亿美元现金收购 Synthorx,而 Synthorx 最重要的管线产品是改良后的白介素-2 THOR-707。我们来看一下这个产品的数据。下图,左边的数据是指单次给药后,第 17 天时各剂量组肿瘤体积的大小。从图中可以看到,6 mg/kg 组已经表现出良好的肿瘤抑制效果。因此,在右边与 PD-1 联用的实验中,选择了 6 mg/kg 作为给药剂量。从右边的结果,我们可以得知,在 CT-26 肿瘤模型小鼠中,THOR-707 与 PD-1 抗体联用,36% (5/14) 的小鼠生存且肿瘤完全消失(CR,完全缓解)。
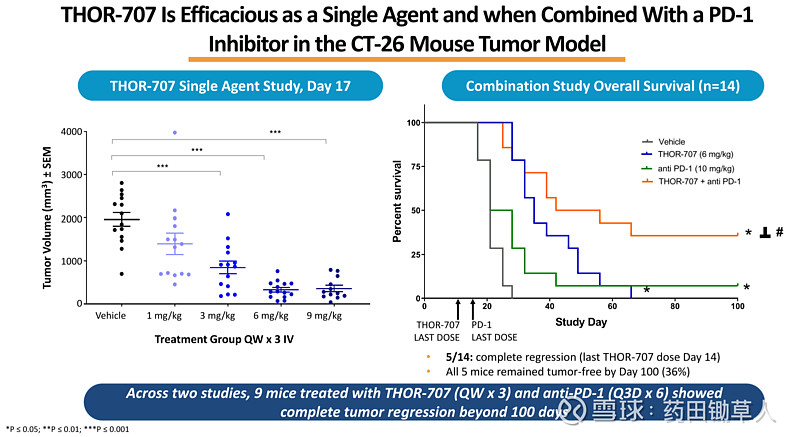
我们知道,PD-1 抗体有一个明显的缺陷就是有效率偏低,部分适应症只对 20% 左右的患者有效。因此,寻找 PD-1 抗体的黄金搭档成为肿瘤药物研发领域的热门方向。而 THOR-707 在上面的动物实验中就展现出了这种潜力。那么,这个数据到底有多好呢?我们再来看更早之前的一笔交易。
2018 年 2 月,BMS 花费 36 亿美元的天价,买下了 Necktar 公司 NKTR-214 的部分权益,并同时打算开启针对超过 20 种癌症,总计超过 15000 人的史上最大规模临床试验。其中,NKTR-214 与 THOR-707 一样,也是一种改良的白介素-2。下图是 NKTR-214 与 PD-1 抗体联用时,对 CT-26 肿瘤模型的抑制效果。结合给药方案,可知在治疗第 21 天时,NKTR-214 以 0.8 mg/kg 剂量与 PD-1 抗体联用,可以达到 76% 的抑瘤率(GRI),但是在肿瘤完全缓解率(CR)指标上的表现似乎要差一些。
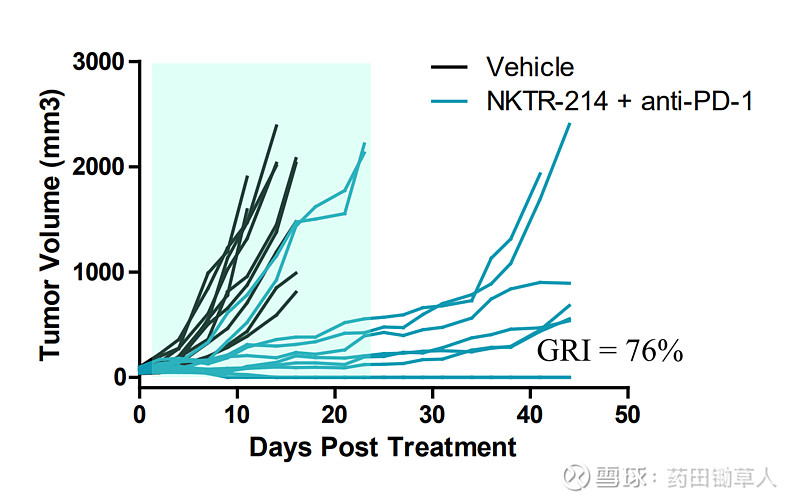
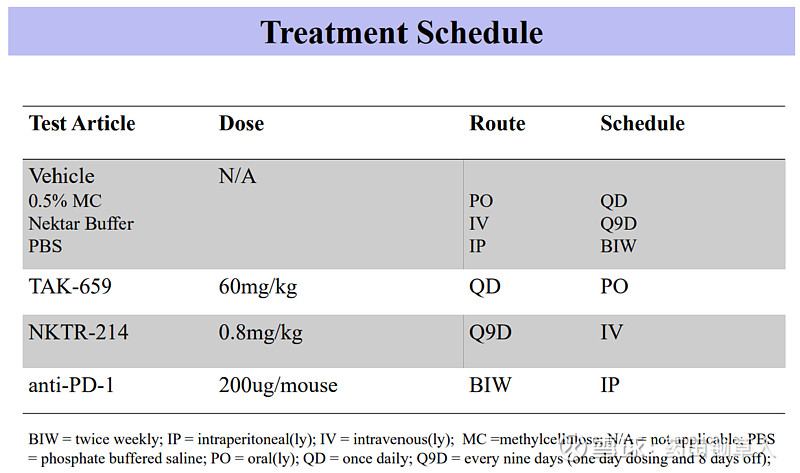
因为没有 THOR-707 与 NKTR-214 头碰头直接对比的数据,我们暂时很难得出孰优孰劣的结论,但是我们通过各自的数据对比,可以大致知道在与 PD-1 联用时,两者的在同一模型上的疗效表现都展示出了提高 PD-1 有效率的潜力。而且,或许是由两者的改造策略有所不同,两个产品的给药剂量有较大差异。
量效关系
量效关系,从字面意思来理解,就是剂量与疗效之间的关系。通常来说,在一定范围内,剂量越大,疗效越好。在预期达到同样的疗效时,我们希望给药剂量越小越好。因此,从下图的量效曲线中,我们通常比较关注的数据是最小有效浓度/剂量以及半数有效浓度/剂量。
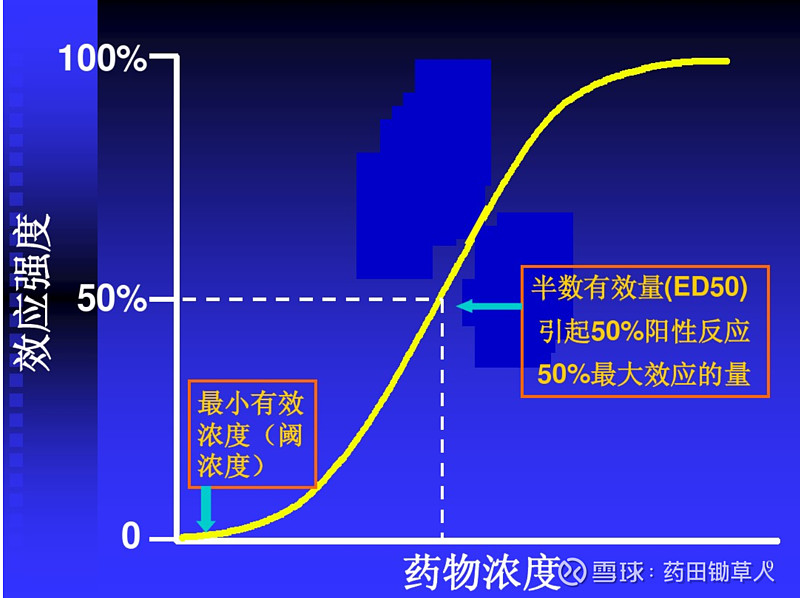
借助量效关系,结合安全性数据,我们可以大致推测药物的有效剂量范围,后面我再对这部分详细展开。
药物选择性
药物的选择性考察希望药物对某一特定靶点的具有高选择性而对其它靶点具有较低的选择性,其目的是希望从机制上来避免药物的非靶标毒性。我们上面提到的 THOR-707 和 NKTR-214 其实就是从靶点选择性方面进行优化,来起到降低 IL-2 较大毒副反应的效果。
总结
本文简要介绍了临床前药效评价中一些比较重要的概念和指标,希望能对大家了解药物的临床前药药效评价有所帮助。不过,我们也应该认识到,药物研发是一项系统工程,本文在介绍相关概念的同时,也希望能尽量提供一种学习引导,这样大家在遇到陌生概念时也可以通过网络自行学习掌握。
后面的文章我们再来关注安全性评价相关的内容,结合本文介绍的药效指标,我们就可以更为综合的对药物性质进行评价。敬请大家转发关注,谢谢。
$恒瑞医药(SH600276)$ $百济神州(BGNE)$ $亚盛医药-B(06855)$
Nektar、BMS、Sanofi