

8月15日,国家药监局药品审评中心官网公示,$东阳光(SH600673)$ 旗下宜昌东阳光长江药业递交的英强布韦片的上市申请已获得受理。英强布韦是一款在研1类新药,拟开发与安泰他韦联合用于丙肝的治疗,其中安泰他韦的上市申请已于8月初获受理。

截图来源:CDE官网
丙型病毒性肝炎(简称:丙肝)是一种由丙型肝炎病毒(HCV)感染引起的、以慢性隐匿性感染为主、对肝脏损害较大的传染病, 属于乙类传染病。主要通过血液传播、性接触传播及母婴传播,目前没有可以有效预防的疫苗。
据中国《丙型肝炎防治指南(2022年版)》统计数据丙型肝炎呈全球性流行,不同性别、年龄、种族人群均对HCV易感。据WHO估计,2015年全球有慢性HCV感染者7100万例,39.9万例死于HCV感染引起的肝硬化或HCC(肝癌)。2019 年全球有慢性HCV感染者5800万例,29万例死于HCV感染引起的肝硬化或HCC,2019年全球新发感染者约150万例。
根据药融云全国医院销售数据库显示,2020年全国医院销售额涨幅高达70%,肝炎用药市场需求量仍然巨大,且未来将继续保持高增长态势。到2022年,我国肝炎用药医院端市场规模已达到7.8亿元。
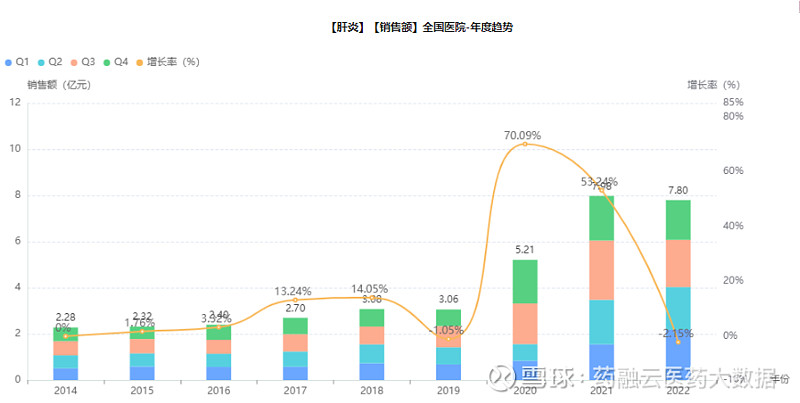
截图来源:药融云全国医院销售数据
据东阳光官网信息,公司拟开发安泰他韦联合英强布韦片治疗丙肝(全基因型)患者。中国药物临床试验登记与信息公示平台官网公示信息显示,东阳光已经完成了一项评价磷酸安泰他韦胶囊联合英强布韦片治疗成人慢性丙型肝炎的2/3期临床研究。该试验在中国58家医疗机构开展,主要研究者为北京清华长庚医院主任医师魏来,入组患者500多例。
这项2/3期临床试验以治疗结束后12周时实现持续病毒学应答的受试者百分比(SVR12)为衡量指标,旨在评价和验证磷酸安泰他韦胶囊联合英强布韦片治疗成人各基因型慢性丙型肝炎的疗效。
7月31日,东阳光最新公示一项英强布韦片的I期临床试验,为[14C]英强布韦在中国成年男性健康受试者体内的物质平衡I期临床试验。

截图来源:药融云中国临床试验数据库
据药融云数据库,在丙肝领域,2020年12月,东阳光开发的1类新药磷酸依米他韦胶囊已获得中国国家药监局获批上市,与索磷布韦片联合用于治疗成人基因1型非肝硬化慢性丙型肝炎患者。4类仿制药索磷布韦片于今年7月获批上市,为该品种第6家过评的药企。
其他药企布局丙肝领域
丙肝的治疗大致可以分为四个阶段:普通干扰素治疗、普通干扰素联合利巴韦林治疗、聚乙二醇干扰素联合利巴韦林治疗、直接抗病毒 药物(DAA)治疗,其中DAA药物的发现,大幅提高了全球丙肝治疗水平,使丙肝成为一种能够治愈的传染病。
丙肝领域是吉利德、艾伯维、BMS的天下,吉利德的索磷布韦片自上市后,该药凭借超过95%的综合治愈率、治疗周期仅3个月等优势很快成为全球范围内最主流的治疗方案。国内也有企业开始布局DAA药物仿制药市场,其中$凯因科技(SH688687)$ 已于2020年3月取得索磷布韦片仿制药的生产批件,南京正大天晴、广生堂药业、$石药集团(01093)$ 、四环制药也相继布局其中。
<END>