
【引言】为什么要写公司深度文章,因为我们面对的投资噪音太多,经常只见树木不见森林,无法了解生意的本来面貌。我们立足于公开信息,客观理性分析,提出深度观点,还原生意本质。

之前在《公司深度 | 常山药业4:药品注册流程(硬核干货)》一文中写到“若有其他新的证据表明可以大大缩短审评时间,后续及时更新。”今天,它来了!
先说结论:常山药业上市许可申请涉及的技术评审延续特殊审批政策,审批时限为一百二十工作日。
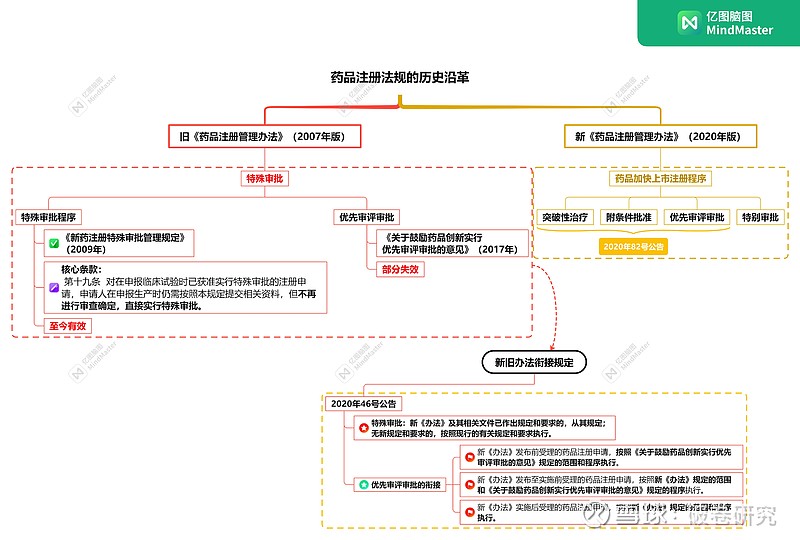
常山药业药品注册程序横跨了十年的周期,经历了新旧药品注册管理办法的规范。简单来说,临床注册适用于旧的药品注册管理办法,上市申请适用于新的管理办法。新的药品注册管理办法很多条款延续了旧的药品注册管理办法(条文并没有完全取代)。因此要完全说清楚常山药业的上市许可申请适用的政策,需要系统梳理药品注册管理法规的历史沿革。新旧药品注册管理相关法规,一共涉及六个文件,由“2个办法+1个规定+1个意见+2个公告组成”。
特殊审批政策
一、旧《药品注册管理办法》(2007年版)
在旧《药品注册管理办法》(下称“旧办法”)关于加快药品审评审批的程序只有特殊审批。第四十五条:
国家食品药品监督管理局对下列申请可以实行特殊审批:
(一)未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂,新发现的药材及其制剂;
(二)未在国内外获准上市的化学原料药及其制剂、生物制品;
(三)治疗艾滋病、恶性肿瘤、罕见病等疾病且具有明显临床治疗优势的新药;
(四)治疗尚无有效治疗手段的疾病的新药。
常山药业符合第(二)款之特殊审批的规定,即未在国内外获准上市的化学原料药及其制剂、生物制品,常山药业2014年临床试验申请就是按照特殊审批程序批准的。
第一百五十条对技术评审工作时限做了规定:
第一百五十条 技术审评工作时间按照下列规定执行:
(一)新药临床试验:90日;获准进入特殊审批程序的品种:80日;
(二)新药生产:150日;获准进入特殊审批程序的品种:120日;
二、《新药注册特殊审批管理规定》(药监注[2009]17号)
经反复阅读法规条文及查证,新药注册特殊审批管理规定(以下简称“规定”)规范的内容至今仍然有效,没有被废止!在该规定中明确了特殊审批的适用范围及执行细则。其中第十九条尤为重要:
对在申报临床试验时已获准实行特殊审批的注册申请,申请人在申报生产时仍需按照本规定提交相关资料,但不再进行审查确定,直接实行特殊审批。
这意味着常山药业在2014年临床阶段适用的特殊审批政策,会继承至上市申请环节。即上市许可申请环节中技术评审的审批期限符合特殊审批制度的规定:获准进入特殊审批程序的品种:120日。
优先审评审批政策
一、《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号)
最早出现优先审评审批的政策可以追溯到食品药品监管总局于2016年2月发布的《食品药品监管总局关于解决药品注册申请积压实行优先审评审批的意见》(食药监药化管〔2016〕19号),该文件后被食药监药化管〔2017〕126号《关于鼓励药品创新实行优先审评审批的意见》取代。上述两个文件一脉相承,主要是为了解决药品注册申请积压的矛盾,首次提出了优先审评审评的方案,对各个审批子环节的时限进行了规定,但没有对总的审批时限做规定,仍然没有脱离于旧药品注册管理办法的规范。该意见至今部分有效。
按照该文件的规定,常山药业符合优先审评审批的规定,即 :
(一)具有明显临床价值,符合下列情形之一的药品注册申请:
1.未在中国境内外上市销售的创新药注册申请。
......
7.列入国家科技重大专项、国家重点研发计划,以及由国家临床医学研究中心开展临床试验并经中心管理部门认可的新药注册申请。
二、新《药品注册管理办法》(2020年版)
在新的《药品注册管理办法》(下称“新办法”)第四章规定了四类药品加快上市注册程序,分别是突破性治疗药物程序、附条件批准程序、优先审评审批程序以及特别审批程序。优先审评审批程序延续和旧办法的思想,在新办法中对此做了更为具体的规定。新办法第六十八条,对适用范围做了明确规定:
药品上市许可申请时,以下具有明显临床价值的药品,可以申请适用优先审评审批程序:
(一)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;
(二)符合儿童生理特征的儿童用药品新品种、剂型和规格;
(三)疾病预防、控制急需的疫苗和创新疫苗;
(四)纳入突破性治疗药物程序的药品;
(五)符合附条件批准的药品;
(六)国家药品监督管理局规定其他优先审评审批的情形。
若完全按照新办法,常山药业不符合优先审评审批的情形。
三、国家药监局关于发布《突破性治疗药物审评工作程序(试行)》等三个文件的公告(2020年第82号)
在2020年7月,为配合《药品注册管理办法》实施,国家药品监督管理局组织制定了《突破性治疗药物审评工作程序(试行)》《药品附条件批准上市申请审评审批工作程序(试行)》《药品上市许可优先审评审批工作程序(试行)》。其中《药品上市许可优先审评审批工作程序(试行)》对符合优先审评审批的药物做了具体程序上的规范。在此不再赘述,有意者可以查询相关法规条文。
四、国家药监局关于实施《药品注册管理办法》有关事宜的公告(2020年 第46号)
为了衔接新旧药品注册管理办法,药监局出台了2020年46号公告。公告的核心指导内容是:新《办法》及其相关文件已作出规定和要求的,从其规定;无新规定和要求的,按照现行的有关规定和要求执行。药品注册申请受理、审评和审批的有关工作程序,新《办法》及其相关文件尚未作调整的,按照现行规定执行。
该文件明文规定新办法没有规定和要求的,按照旧办法旧相应规定执行!
根据该公告,这里有两点需要进一步解读:
1、特殊审批政策在新办法中没有规范,也没有删除。按照公告内容,关于特殊审批政策应当按照旧办法执行。据此得出常山药业上市许可符合特殊审批政策的结论。
2、优先审评审批政策发生变动,公告第六条明确了现新旧衔接规定:
优先审评审批的范围和程序按以下规定执行:
(一)新《办法》发布前受理的药品注册申请,按照《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号)规定的范围和程序执行。
(二)新《办法》发布至实施前受理的药品注册申请,按照新《办法》规定的范围和《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号)规定的程序执行。
(三)新《办法》实施后受理的药品注册申请,按照新《办法》规定的范围和程序执行。
常山药业符合第(一)款之规定,即新《办法》发布前受理的药品注册申请。据此推断常山药业符合优先审评审批政策。
特殊审批OR优先审评审批
基于以上分析,常山药业上市许可申请理论上同时符合特殊审批和优先审评审批政策,由于二者没有叠加属性,故二者选其一。
新的药品注册管理办法规定的优先审评审批程序的审批时限涵盖了药品注册核查,注册检验及综合评审三个环节。假定旧的药品注册管理办法也遵从同样的逻辑,即注册检验和技术评审并行,且常山药业做了最优选择主动向药监局提出了相关申请:按照特殊审批程序,审批时限为一百二十工作日。
(注:以上不包括行政审批时长及制证时长)

风险提示:本内容仅代表破卷研究的分析、推测与判断,登载于此仅出于传递信息之目的,不作为投资具体标的之依据。投资有风险,入市需谨慎!
版权声明:本内容版权归原创方或原作者所有,如转载使用,请注明来源及作者、文内保留标题原题以及文章内容完整性,并自负版权等法律责任。
$常山药业(SZ300255)$ #胰岛素#