台湾生物医药产业经过30年的发展,已经到了非常成熟的阶段,在国际化的进程中,他们比国内的企业走得更远,有一些企业甚至在美国走完了整个新药注册申请,且已经在美国上市的NCE。目前,台湾上市的生物技术公司超过44家,市值超过1,840亿元。然而,台湾企业面临的最大的问题是,台湾本土市场太小,再加上近期经济下行,促使更多的拥有优质项目的台湾企业寻求向外发展。大陆市场是台湾企业无法忽视的一块市场。然而,台湾药品在准入大陆市场时,一直被当作是进口产品引进,审评审批时间长,且需要提供长时间的临床前研究,尤其是长期的毒理研究以及生殖毒理研究,而有一些新药其实是同类靶点中国际进展比较靠前的。在这种情况下,不仅耗费更多的人力财力,而且还会拖慢研发进度,失去其在国内市场的先发优势。在临床试验方面,两岸基于同为亚裔种族,有相似的疾病形态,以及两岸药物法规在国际法规ICH的规范下已同步化,若能够以整合型临床试验在两岸同时收纳临床病人,并以相同的NDA文件向TFDA及CFDA进行药品注册申请,则可以大幅拓展两岸新药共同研发合作的利基。基于这一点来解读CFDA的发文,甚有深意。
2在大陆申报的1.1类新药台湾企业列表
在明确的两岸合作申报的官方文件出来以前,其实已经有一些台湾企业走在了前面。通过咸达数据V3.2的数据,我们发现以下台湾企业已经在国内进行了药品的申报:
表1.在大陆申请临床的台湾企业

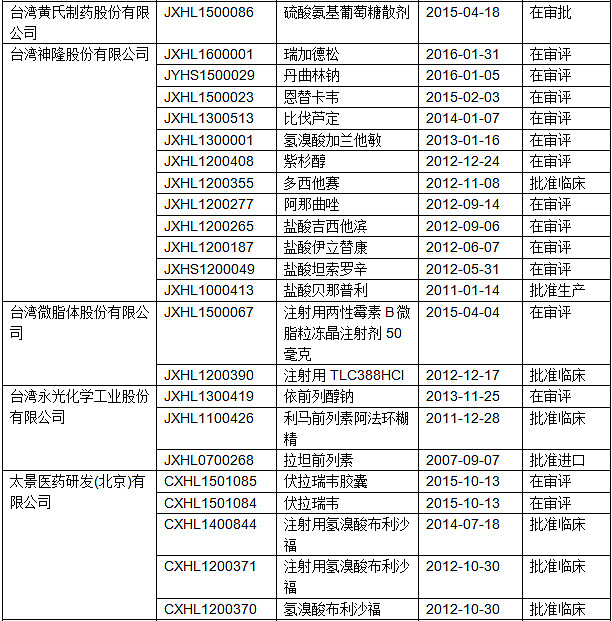
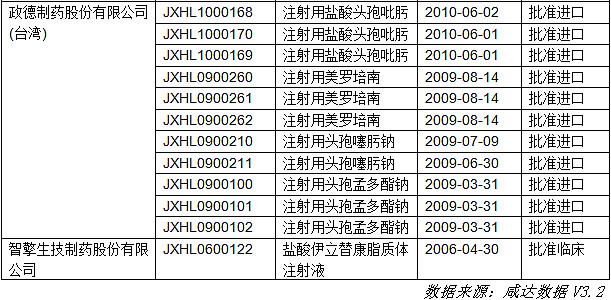
由上表可知,已经有15家以上的台湾企业在大陆进行了药品的临床申请,大部分为进口申请,只有太景生物科技一家按照1.1类新药进行申请。
太景生物科技是成立于2001年的一家台湾公司,专注于小分子新药研发。产品线上的3个主要产品(奈诺沙星,步利沙福以及治疗丙肝的药物伏拉瑞韦)均已到CFDA进行申报,其中的奈诺沙星已经授权浙江医药进行销售,现处于生产核查阶段,一旦获批将会是台湾第一家在大陆上市的1.1类新药。丙肝药物伏拉瑞韦也正积极参与到国内的丙肝研发竞赛中,值得一提的是,该药已经与东阳光药业联合开发,两岸临床互认或将加快二者的研发进程。
台湾有些生物技术公司虽然没有在国内CFDA申报产品,但已将产品申报美国FDA。例如,中裕新药和心悦生医已经陆续获得美国FDA认定的具有“突破性疗法”;国鼎制药获得孤儿药认证;华药、杏国、台睿等企业也都有项目在美国申报。这些生物制药企业如果想进入大陆市场,两岸临床试验机构互认对他们来说是一个不错的选择。而更多的大陆企业也可以考察台湾这些企业的项目,将他们引入内地市场。
正是由于台湾一些生物技术公司看到大陆广阔的市场,已经积极在探索大陆市场的准入制度,他们自发结盟,致力于两岸的医疗合作,现今已查到的联盟成员有:上智生计创业投资股份有限公司,上腾生计顾问股份有限公司,友霖生计医药股份有限公司,太景生物科技股份有限公司,台睿生物科技股份有限公司,友华生计医药股份有限公司,杏辉药品工业股份有限公司,建乔信元医药生计股份有限公司,晟德大药厂股份有限公司,台湾浩鼎生计股份有限公司,台湾微脂体股份有限公司,永昕生物医药股份有限公司,安成生物科技股份有限公司,杏国新药股份有限公司,泰宗生物科技股份有限公司,基亚生物科技股份有限公司,智擎生计药业股份有限公司,雅详生计医药股份有限公司,药华医药股份有限公司,心悦生医股份有限公司,亚狮康股份有限公司,台湾尖端先进生计医药股份有限公司以及保瑞医药股份有限公司。如果大陆的公司需要展开两岸合作,以上的公司或许是一个不错的选择。
3结语
台湾的生物医药产业发展得相对成熟,大陆的研发也在奋起直追,但后期的临床研究依旧是我们的软肋。如果二者能够借助各自的长处进行更加深入的合作,那么对于双方来说都是双赢的选择。